主な違い – モル体積 vs 部分モル体積
モル体積とは、ある物質1モルの体積のことである。
モル体積は記号 Vm で表される。
標準的な温度と圧力では、理想気体のモル体積は 22.4 L/mol です。
しかし、他の物質では、モル体積は体積を測定する温度と圧力に大きく依存する。
一方、部分モル体積は複雑な用語です。
これは、混合物全体の体積に対する、ある成分の寄与度として定義することができる。
モル体積と部分モル体積の主な違いは、ある物質のモル体積がその物質1モルの体積であるのに対し、部分モル体積はその混合物にある成分を加えたときの体積の変化であることです。
モル体積とは
モル体積とは、ある温度と圧力において、ある物質1モルが占める体積のことです。
物質には気体、液体、固体があります。
モル体積の化学記号はVmです。
標準的な温度と圧力での理想気体のモル体積は22.4L/molです。
モル体積の計算
理想的な振る舞いの場合、PV = nRT
温度と圧力の標準値は、それぞれ273Kと1.00atmです。
(1.00 atm) x Vm = (1 mol) x (0.08206 L atm mol-1 K-1) x (273 K) となります。
Vm = 22.4 L/mol
モル体積のSI単位は立方メートル/モル(m3/mol)です。
しかし、一般には気体は立方デシメートル毎モル(dm3/mol)、液体や固体は立方センチメートル毎モル(cm3/mol)が使われることが多い。
モル体積=モル質量/密度
ある物質のモル体積は、上記のモル質量と物質の密度の関係から単純に計算できる。
しかし、複数の成分の混合物であれば、単純に各成分の和とすることができる。
しかし、液体の混合物の中には、この考え方に反するものがあります。
例えば、水とエタノールを混ぜた場合、計算上のモル体積はそれぞれのモル体積の合計値ではなく、減少した値になる。
これは、水分子とエタノール分子の間に分子間力が発生するために起こる。
部分モル体積とは
部分モル体積とは、物質の熱力学的性質の一つで、混合物全体の体積に対する混合物中の成分の寄与度として定義される。
これは、ある成分を1モル加えたときの体積の変化です。
この概念を理解するために、例を挙げて考えてみましょう。
- 25℃の大量の水に少量の水を加えると、水の体積は18.07cm3/mol増加する。しかし、エタノールに水を加えると、同じ温度と圧力で体積は14 cm3/molしか増えません。
- これは、エタノール分子と水分子の間に水素結合が形成されるためです。エタノール分子は、水素結合を形成することができる-OH基を持っています。水素結合が形成されると、分子同士が近づき、体積は予想より小さくなる。
- 従って、25℃のエタノール中の水の部分モル体積は14cm3/molとなる。
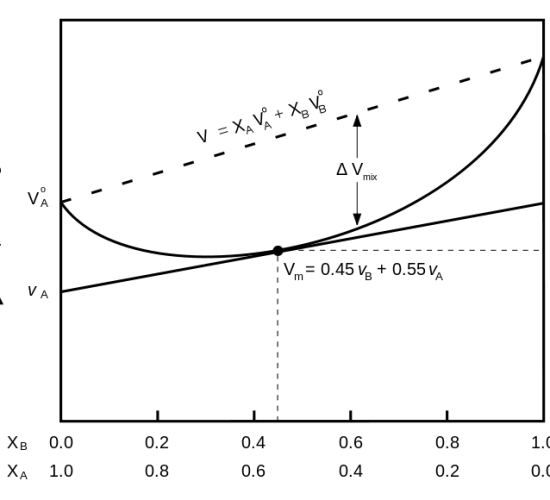 図1:混合物の部分モル体積を表す曲線
図1:混合物の部分モル体積を表す曲線
上の図は、2つの成分を含む混合物の部分モル体積を示したものです。
グラフの点線は予想される体積を表している。
しかし、実際の体積はΔVmixだけ減少している。
モル体積と部分モル体積の違い
定義
モル体積。
モル体積とは、ある温度と圧力において、ある物質1モルが占める体積。
部分モル体積。
部分モル体積は、物質の熱力学的特性であり、混合物の全体積に対する混合物中の成分の寄与として定義される。
原則
モル体積。
モル体積とは、ある物質のモル質量をその物質の密度で割った体積のことである。
部分モル体積。
部分モル体積とは、ある成分を混合したものに、ある物質を加えたときの体積の予期せぬ変化を表す。
物質名
モル体積。
モル体積は、液体、固体、気体について測定できる。
部分モル体積。
部分モル体積は、液体と液体の混合物によって表示されます。
結論
モル体積と部分モル体積は、熱力学の関連用語です。
どちらも1モルあたりの系の体積変化を表す用語です。
モル体積と部分モル体積の主な違いは、ある物質のモル体積はその物質1モルの体積であるのに対し、部分モル体積はその混合物にある成分を加えたときの体積の変化であることである。
