主な違い – 誘導効果 vs 共鳴効果
誘導効果とは、分子内の原子に電荷が誘導されることによって起こる効果です。
この電荷の誘導は、原子の電気陰性度の違いによって起こります。
電気陰性度の高い原子は、それ自身に結合電子を引き寄せる傾向があります。
しかし、共鳴効果は誘導効果とは異なる。
分子の共鳴効果は、その分子に二重結合がある場合に生じる。
誘導効果と共鳴効果の主な違いは、誘導効果が分子内の原子間の電荷の伝達を表すのに対し、共鳴効果は分子内の原子間の電子対の伝達を表すことである。
帰納的効果とは
誘導効果とは、原子の連鎖によって電荷が伝達されることで生じる効果です。
この電荷の伝達により、最終的に原子の電荷は固定される。
誘導効果は、分子を構成する原子の電気陰性度の違いにより発生する。
電気陰性度の高い原子は、電気陰性度の低い原子に比べて、電子を自分の方に引き寄せる傾向があります。
そのため、電気陰性度の高い原子と低い原子が共有結合している場合、結合電子は電気陰性度の高い原子の方に引き寄せられる。
このため、電気陰性度の低い原子は部分的に正電荷を帯びることになります。
電気陰性度の高い原子は、部分的に負の電荷を得ることになります。
これは結合分極と呼ばれます。
誘導効果は、以下の2つの方法で見出されます。
電子引出し誘導効果
電気陰性度の高い原子または基が分子に結合している場合に生じる。
この原子または基は、分子の他の部分から電子を引き寄せる。
電子放出型誘導効果
この効果は、アルキル基のような基が分子に結合している場合に見られる。
このような基は電子吸引力が弱く、分子の他の部分に電子を与える傾向があります。
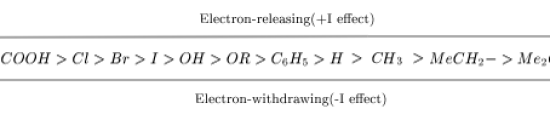 図1: さまざまな基がもたらす誘導効果
図1: さまざまな基がもたらす誘導効果
誘導効果は、分子、特に有機分子の安定性に直接的な影響を与える。
炭素原子が部分的に正電荷を帯びている場合、アルキル基などの電子放出基が電子を供給することで、この部分的な正電荷を減らしたり取り除いたりすることができる。
すると、その分子の安定性が増す。
レゾナンス効果とは
共鳴効果とは、π結合電子間の相互作用により分子の安定性に影響を与えることを言います。
分子の原子に孤立電子対が存在する場合、孤立電子対も分子の共鳴に寄与することがあります。
共鳴効果により、原子間の電子が非局在化する。
二重結合を持つ分子は共鳴に関与している。
分子の本当の構造を知るために、共鳴構造を利用することができる。
分子の本当の構造は、共鳴安定化によって得られる中間構造です。
共鳴構造は、元の分子の異性体ではない。
ある分子が他の共鳴構造を持たず、たった一つの構造しか持たない場合、それはその分子が存在しうる最も安定な構造です。
共鳴構造はルイス構造として描かれる。
ある分子に対して取りうるすべての構造を書くことで、その分子にとって最も安定な中間構造を決定することができる。
誘導効果と共鳴効果の違い
定義
誘導効果:原子の連鎖によって電荷が伝達されることによって生じる効果。
共振効果。
π結合電子間の相互作用により、分子の安定性に影響を与えること。
原因・結果
誘導効果。
結合の分極により誘導効果が発生する。
共振効果。
単結合と二重結合が一緒に存在することにより、共鳴効果が起こる。
これらの効果に影響を与える要因について
誘導効果。
原子の電気陰性度が誘導効果の大きさに影響する。
共鳴効果。
二重結合の数とその配置が共鳴効果に影響を与える。
結論
誘導効果と共鳴効果は、分子の原子間の電子の分布に関係するものです。
しかし、これらの効果の形成機構を考える場合、両者は異なる用語です。
誘導効果と共鳴効果の大きな違いは、誘導効果が分子内の原子間の電荷の伝達を表すのに対して、共鳴効果は分子内の原子間の電子対の伝達を表すことである。
