主な違い – 酸化数 vs 酸化状態
酸化数と酸化状態は、同じものとして考えられることが多い。
これは、特定の原子が位置する化合物の種類によって、酸化状態が酸化数と等しくなることがあるからです。
しかし、酸化数と酸化状態には若干の違いがあります。
酸化数と酸化状態の主な違いは、酸化数が配位錯体の中心原子の電荷(周りの結合がすべてイオン結合の場合)であるのに対し、酸化状態は特定の原子が他の原子と失ったり得たり共有したりできる電子の数である点です。
酸化数とは
酸化数は、配位錯体の中心原子の周りの結合がすべてイオン結合であった場合の電荷と定義することができる。
配位錯体とは、中心金属原子が複数の配位子と結合した化学構造です。
中心金属原子があることから、金属錯体とも呼ばれる。
この中心の金属原子を配位中心と呼びます。
配位子とは、金属原子に配位結合(配位共有結合)を介して結合している化学基のことです。
配位化合物は、複数の配位錯体を含んでいる。
中心金属原子は、ほとんどの場合、遷移金属(dブロック元素)です。
配位結合は、電子を多く含む種がその電子対(1対または2対)を中心原子に供与することで形成される。
これらの供与体は配位子と呼ばれる。
配位子には、中性分子と負電荷を帯びたイオンがあります。
この配位結合は、2つの原子の電子共有により形成されるため、共有結合です。
中心原子に結合しているドナー原子の数を配位数と呼びます。
配位子には、単座配位子と二座配位子があります。
単座配位子は1つの配位結合で中心原子と結合し、二座配位子は2つの配位結合で結合します。
配位数は、配位錯体の形状を決定する。
しかし、配位数は中心原子の酸化数ではありません。
しかし、配位数は中心原子の酸化数とは異なりますが、配位数と酸化数が等しい場合もあります。
上の図は、[Co (NH3)6] Cl3 錯体を示しています。
コバルト原子にアンモニアの配位子が6個結合しているので、コバルトの配位数は6です。
しかし、コバルトの酸化数は3です。
酸化数とは、配位錯体の中心原子の周りの配位子を全て取り除いた場合の電荷のことです。
3個のCl原子は-3個の電荷を生じ、アンモニア分子は中性に帯電しているので、Cl原子から来る電荷を中和するためにコバルト原子は+3個の電荷を持つはずです。
したがって、コバルトの酸化数はCo (III)と表記されます。
酸化状態とは
酸化状態とは、ある原子が他の原子から奪ったり、獲得したり、共有したりできる電子の数のことです。
この用語は、配位錯体だけに限定されるものではありません。
酸化状態は、化合物中の原子の酸化の度合いを示すものです。
酸化状態は常に整数で与えられ、原子の電荷も含めてヒンドゥー・アラビア数字で表される。
酸化状態を決定するためのルール
原子の酸化状態は、7つのルールで与えられます。
ルール1
単一元素および単一元素からなる化合物は、各原子ごとに酸化状態がゼロです。
例えば、N2という化合物中の窒素(N)の酸化状態はゼロです。
ルール2
化合物の全電荷は、各元素の電荷の合計です。
例えば、NaCl のような中性種では、全電荷はゼロです。
したがって、各元素の酸化状態は、Na (+1) と Cl (-1) で示される必要がある。
NH4+のようなイオン種では、NとH原子の酸化状態の和が全体の電荷に等しいはずです。
(N + 4H) = (-3) + (1 x 4) = +1
ルール3
第1族金属(1A)の酸化状態は常に+1であり、第2族金属(2A)の酸化状態は常に+2です。
例えば、リチウム(Li)の酸化状態は常に+1、マグネシウム(Mg)の酸化状態は常に+2です。
ルール4
フッ素(F)の酸化状態は常に-1です。
F2のフッ素の酸化状態は、最初のルールに従って0であることを忘れないでください。
ルール5
他の原子に比べて最も電気陰性度の高い原子が負電荷を帯びる。
例えば、フッ素は水素よりも電気陰性度が高い。
したがって、HFの場合、水素の酸化状態は-1です。
しかし、通常、水素の酸化状態は+1です。
ルール6
水素(H)の酸素の状態は、通常+1です。
水素原子は電子を失いやすく、陽イオンになりやすい。
しかし、水素が1A族や2A族の金属と結合すると、水素の酸化状態は-1になってしまいます。
ルール7
酸素の酸化状態は、通常-2です。
酸素は電気陰性度が高く、電子を引き付けます。
そのため、容易に-2の酸化状態を形成します。
しかし、過酸化物では、2個の酸素原子が単結合で結合しているので、酸化数は-1です。
酸化還元反応における生成物の決定には、この酸化状態が非常に有効です。
酸化還元反応とは、原子間の電子交換を含む化学反応です。
酸化還元反応では、2つの半反応が並行して起こります。
ひとつは酸化反応、もうひとつは還元反応です。
酸化反応は原子の酸化状態を増加させ、還元反応は原子の酸化状態を減少させる。
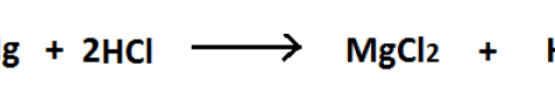 図02:MgとH2との酸化還元反応
図02:MgとH2との酸化還元反応
上の反応では、Mgは酸化状態がゼロ(0)の単体元素です。
しかし、H2との反応後はMgCl2となり、Mgの酸化状態は+2です。
ここでMgの酸化状態が増加する。
従って、この酸化還元反応では酸化半反応となる。
HClのHの酸化状態は+1です。
しかし生成物のH2は酸化状態が0(ゼロ)になっています。
酸化状態が減少しているのです。
したがって、この酸化還元反応では還元半反応となります。
酸化数 と 酸化状態 の違い
定義
酸化数。
酸化数は、配位錯体の中心原子の周りの結合がすべてイオン結合であった場合の電荷と定義できる。
酸化状態。
酸化状態は、ある原子が他の原子から奪ったり、獲得したり、共有したりできる電子の数として定義される。
アプリケーション
酸化数。
配位錯体の場合、酸化番号を適用する。
酸化状態。
酸化状態:元素、化合物を問わず、酸化状態を適用することができます。
数の表現
酸化数。
ローマ数字で酸化数を表す。
酸化状態。
ヒンズー教・アラビア語の数字で表す。
電荷の表し方
酸化数。
酸化数では中心原子の電荷の詳細はわからない。
酸化状態。
酸化状態は、電荷を負(-)または正(+)の記号で表す。
結論
通常の元素や化合物(配位錯体ではなく)であれば、酸化状態と酸化数は同じです。
しかし、配位化合物を含むすべての化合物を考える場合、若干の違いがあります。
酸化数と酸化状態の大きな違いは、酸化数が配位錯体の中心原子の電荷(周りの結合がすべてイオン結合の場合)であるのに対し、酸化状態は特定の原子が他の原子と失ったり得たり共有したりできる電子の数である点です。
