主な違い – 内周軌道錯体と外周軌道錯体
配位錯体とは、中心原子またはイオンの周囲を異なる原子または原子団が取り囲んだ分子構造のことである。
中心原子は遷移金属原子であることが多い。
周囲の原子や原子団は配位子と呼ばれる。
これらの配位子は、中心原子に配位共有結合で結ばれている。
この結合は、配位子のsおよびp分子軌道と金属原子のd原子軌道の間に形成される。
価電子結合理論によれば、金属原子の原子軌道は、結合を形成する前に混成を行う。
この混成パターンに基づいて、配位錯体には内軌道錯体と外軌道錯体の2種類があります。
これらの名称は、金属原子のs軌道とp軌道の位置に対するd軌道の位置によって付けられたものです。
内軌道錯体と外軌道錯体の主な違いは、内軌道錯体では中心金属原子の原子軌道の混成が内殻のd軌道を含むのに対し、外軌道錯体では中心金属原子の原子軌道の混成が最外殻のd軌道を含む点です。
内周軌道コンプレックスとは
内殻金属錯体とは、内殻のd軌道と外殻のs、p軌道を含む原子軌道を混成した中心金属原子からなる配位化合物であり、内殻のd軌道と外殻のs、p軌道を混成している。
つまり、中心金属原子が内殻のd軌道を利用して原子軌道を混成している。
したがって、これらのd軌道は、s軌道やp軌道よりも低いエネルギー準位にある。
内殻軌道錯体における金属原子の混成は、d2sp3が最も一般的です。
しかし、dsp2 のような他の混成もあり得る。
内周軌道錯体の形成について理解するために、ある例を考えてみよう。
例
[Co(NH3)6]+3錯体
コバルト(Co)の電子配置は[Ar]3d74s2です。
NH3配位子は電荷を持たないので、Co原子の酸化状態は+3であるはずです。
Co+3の電子配置は[Ar]3d6です。
In order to form 6 coordinate covalent bonds with the 6 ligands (NH3), 6 atomic orbitals should be hybridized. Therefore, two of the 3d orbitals get hybridized with one 4s orbital and three 4p orbitals.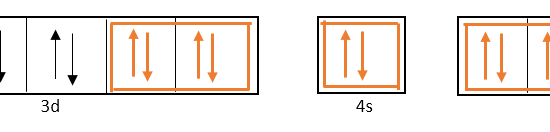
混成に関与するd軌道は電子殻3、s軌道とp軌道は電子殻4にあるので、この金属原子が形成する配位錯体は内軌道錯体と呼ばれます。
オレンジ色の矢印は、6つの配位子から供与された6つの孤立電子対を示しています。
外周軌道コンプレックスとは
金属原子を中心に、最外殻のs、p、d軌道を含む原子軌道が混成した配位化合物です。
このとき、混成に関与するすべての原子軌道は同じエネルギー準位にある。
この混成に関与するd軌道はs軌道とp軌道の外側に位置しているため、これらの金属原子から形成される錯体は外軌道錯体と呼ばれる。
このタイプの錯体で最もよく見られる混成はsp3d2です。
これは、以下に示すような例を用いて説明することができる。
例
[CoF6]-3錯体は、配位錯体です。
コバルト(Co)の電子配置は[Ar]3d74s2です。
F原子1個の電荷は-1です。
したがって、錯体全体の電荷をバランスさせるためには、Co原子の酸化状態は+3である必要があります。
Co+3の電子配置は[Ar]3d6です。
In order to form coordinate covalent bonds, the 4s orbital, three 4p orbitals and two of the 4d orbitals are hybridized.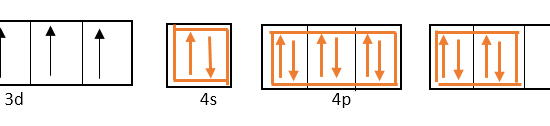
4s、4p、4d軌道が混成に関与しているので、フッ化物イオンから来る一個電子対はこれらの混成軌道に充填されます。
d軌道はs軌道とp軌道の外側に位置するため、これらの金属原子から形成される錯体は外軌道錯体と呼ばれる。
内周回路と外周回路のコンプレックスの違い
定義
内軌道錯体。
内周d軌道を含む原子軌道の混成を受ける金属原子を中心に持つ配位化合物。
外軌道錯体。
中心金属原子が最外周のd軌道を含む原子軌道を混成している座標系化合物。
最も一般的なハイブリダイゼーション
内周軌道錯体。
内軌道錯体で最も一般的な金属原子の混成はd2sp3です。
外周軌道錯体: 外周軌道錯体の金属原子の混成は sp3 d2 が最も多い。
エネルギーレベル
内軌道錯体。
内軌道錯体では、混成に関与するd軌道はs軌道やp軌道よりも低いエネルギー準位にある。
外軌道錯体。
外軌道錯体では、ハイブリッドに関与するd軌道は、s軌道およびp軌道と同じエネルギー準位にある。
電子殻
内周軌道錯体。
金属原子が内殻のd軌道を利用して中心金属原子の混成を行う内殻型錯体。
外周軌道錯体 中心金属原子の混成に最外殻のd軌道を用いる金属原子からなる複合体。
結論
原子軌道の混成は、原子軌道の重なりによる 2 つの原子の結合を記述するために、価電子結合理論で使用されている概念です。
この理論は、配位錯体における結合を説明するために用いることができる。
ここで、配位錯体は、中心原子の混成に用いるd軌道のエネルギー準位によって、内軌道錯体と外軌道錯体の2種類に分かれます。
内軌道錯体と外軌道錯体の主な違いは、内軌道錯体では中心金属原子の原子軌道の混成が内殻のd軌道を含むのに対し、外軌道錯体では中心金属原子の原子軌道の混成が最外殻のd軌道を含む点です。
