上のAddThis共有ボタン
spハイブリダイゼーションとは
sp混成とは、s原子軌道とp原子軌道の間で起こる混成のことです。
電子殻には3つのp軌道があります。
したがって、s軌道とp軌道の1つが混成された後、その原子には混成されていないp軌道が2つ存在することになります。
ここでは、すべてのs軌道とp軌道を単なる原子軌道(s+p)と見なす。
s軌道とp軌道の比率は1:1です。
したがって、s軌道の割合は1/2であり、p軌道の割合は1/2です。
S(またはp)特性割合=全原子軌道数×(1/2)×100
= 50%
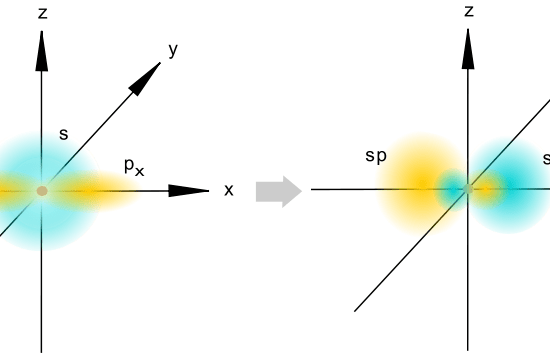 図1: spハイブリッド化
図1: spハイブリッド化
得られたハイブリッド軌道は、s特性が50%、p特性が50%です。
ハイブリッド軌道は2つしか形成されないので、sp軌道の空間配置は直線的です。
2つのハイブリッド軌道は反対方向に向いている。
したがって、これらの軌道の間の角度は180oCとなる。
sp2Hybridizationとは?
sp2混成とは、1つのs原子軌道と2つのp原子軌道が混ざり合うことです。
新たに形成されたハイブリッド軌道はsp2ハイブリッド軌道と呼ばれる。
出来上がったハイブリッド軌道は、sが約33.33%、pが約66.66%となっている。
これは、ハイブリッド化に合計3つの原子軌道が関与しているためで、s特性、p特性の割合は以下のように変化する。
ここでは、sとpの軌道をすべて単なる原子軌道(s+p+p)と考える。
s軌道とp軌道の比率は1:2です。
したがって、S軌道の割合は1/3、P軌道の割合は2/3となる。
Sの特性割合=全原子軌道×(1/3)×100
= 33.33 %
P特性割合=全原子軌道×(2/3)×100%=66.66
= 66.66 %
sp2ハイブリッド軌道の空間配置は、三角形の平面です。
したがって、これらの軌道の間の角度は120oCとなる。
この混成を行う原子は、3つのp軌道のうち2つだけがこの混成に関与するため、混成されていないp軌道が1つある。
spハイブリダイゼーションとは
s
sp2 と sp3 の混成の違い。
定義
sp混成: sp混成は、s原子軌道とp原子軌道の間で起こる混成です。
sp2混成: sp2混成は、1つのs原子軌道と2つのp原子軌道の混合です。
sp3混成: sp3混成は、1つのs原子軌道と3つのp原子軌道が混成することである。
S特性
sp ハイブリッド化。
spハイブリッド軌道のs特性比率は50%です。
sp2ハイブリッド化。
sp2混成軌道のs特性比率は33.33%です。
sp3 ハイブリッド化: sp3ハイブリッド軌道のs特性比率は25%。
軌道間の角度
spハイブリッド化。
sp軌道間の角度は180℃です。
sp2ハイブリダイゼーション。
sp2軌道間の角度は120°C。
sp3ハイブリッド化。
sp3軌道間の角度は109.5°C。
ジオメトリー
spハイブリダイゼーション。
sp混成の軌道配置の幾何学は直線的です。
sp2 ハイブリッド化。
sp2混成の軌道配置は、三角形の平面状です。
sp3ハイブリッド化。
sp3ハイブリッドの軌道配置は四面体です。
ハイブリッド化されていない軌道の数
spハイブリダイゼーション。
spハイブリッド化: ハイブリッド化されていないp軌道が2つできる。
sp2ハイブリダイゼーション。
Sp2ハイブリッド化により、1つのp軌道がハイブリッド化される。
sp3ハイブリッド化。
Sp3ハイブリッド化では、ハイブリッド化されていないp軌道は生じない。
結論
化学における混成とは、異なる原子軌道を混合して、異なる特性を持つ新しい混成軌道を形成することを意味する。
sp、sp2、sp3混成はそのような例です。
sp、sp2、sp3混成の主な違いは、sp混成は50%のs軌道特性を持つ混成軌道を形成し、sp2混成は33%のs軌道特性を持つ混成軌道を形成するのに対し、sp3混成は25%のs軌道特性を持つ混成軌道を形成することである。
