主な違い – カルボニル基とカルボキシル基の違い
有機化学において官能基とは、分子内の特徴的な化学反応を担う化学基のことです。
有機化合物の中には、いくつかの重要な官能基が存在します。
カルボニル基とカルボキシル基は、そのような官能基の一つです。
カルボニル基は、炭素原子が酸素原子に二重結合したものです。
アルデヒドやケトンはカルボニル基含有化合物の一例です。
カルボキシル基は、炭素原子が二重結合で酸素原子に結合し、単結合で水酸基(-OH)と結合したものです。
カルボニル基とカルボキシル基の主な違いは、カルボニル基が炭素原子と酸素原子の二重結合からなるのに対し、カルボキシル基はカルボニル基と水酸基がカルボニル基の炭素原子を介して互いに結合したものであることで、カルボニル基は酸素原子の二重結合からなる。
カルボニルとは
カルボニル基は、炭素原子が酸素原子と二重結合した化学的に有機な官能基です。
カルボニル基を持つ最も単純な有機化合物はアルデヒドとケトンです。
アルデヒドは、化学式-CHOで表されるアルデヒド基から構成されている。
この基は、水素原子に結合したカルボニル基を含んでいる。
ケトンでは、カルボニル基は2つのアルキル基と結合している。
図1:アルデヒドとケトンはカルボニル基を含む
用語説明
- 炭素原子と酸素原子が二重結合で結合した官能基をカルボニル官能基と呼ぶ。
- カルボニル基を有する化合物は、カルボニル化合物と呼ばれる。
- カルボニル基中の炭素原子はカルボニル炭素と呼ばれる。
カルボニル炭素はsp2混成炭素です。
したがって、二重結合と同時に2つの単結合を形成することができる。
カルボニル基にはすでにC=Oの二重結合が存在する。
したがって、カルボニル炭素はさらに2つの単結合を形成することができる。
しかし、カルボニル炭素の周りの幾何学的形状は三角形の平面です。
C=O結合は、炭素と酸素の電気陰性度の違いにより分極している。
酸素はより電気陰性であり、結合電子対を自分自身に引き寄せます。
そのため、酸素原子は部分的に負電荷を帯び、炭素原子は部分的に正電荷を帯びる。
このカルボニル炭素は、求核剤によって攻撃される可能性があります。
このカルボニル基の極性が、アルデヒドやケトンの反応性を高めている。
また、カルボニル化合物の沸点が高くなる原因ともなっている。
カルボニル化合物の例
- アルデヒド類
- ケトン類
- カルボン酸
- エステル類
- アミド類
- エノン
- ハロゲン化アシル
- 酸無水物
カルボキシルとは
カルボキシル基は、炭素原子が酸素原子に二重結合し、水酸基に単結合した有機官能基です。
したがって、カルボキシル基はカルボニル基と水酸基が結合したものです。
カルボキシル基の化学式は-COOHです。
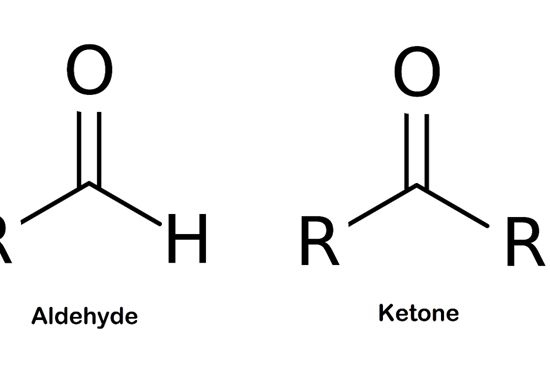 図2: カルボキシル基の化学構造
図2: カルボキシル基の化学構造
カルボキシル基を持つ化合物の代表格はカルボン酸です。
カルボン酸は、カルボキシル基と水素原子またはアルキル基が結合したもので、ジカルボン酸は、カルボキシル基と水素原子またはアルキル基が結合したものです。
ジカルボン酸は、カルボン酸を2つ持つ化合物です。
カルボキシル基はイオン化して、水酸基からプロトン(水素原子)を放出することができます。
このプロトンは遊離プロトンとして放出されるため、カルボン酸は酸です。
プロトンが放出されると、水酸基の酸素原子はマイナスの電荷を帯びます。
この酸素原子の電子をカルボキシル基のもう一つの酸素原子と共有することで、この負の電荷は安定化される。
したがって、イオン化した形は安定です。
カルボキシル基を含む化合物は二量体を形成することがあります。
二量体とは、構造的に類似した2つのモノマーが結合でつながったオリゴマーです。
カルボキシル基の水酸基は水素結合を形成することができるため、カルボキシル基同士の水素結合を形成する。
このため、二量体が形成される。
カルボニル基とカルボキシル基の類似性
- 両者とも酸素原子に二重結合で結合したカルボニル炭素原子を持つ基です。
- どちらも有機化合物の官能基です。
- 両者ともsp2混成カルボニル炭素原子を含む。
カルボニルとカルボキシルの違い
定義
カルボニル。
カルボニル基は、炭素原子が酸素原子に二重結合した化学的に有機な官能基です。
カルボキシル基。
カルボキシル基は、酸素原子に二重結合した炭素原子と水酸基に単結合した有機官能基です。
化学式
カルボニル基 カルボニル基の化学式は、-C(=O)-です。
カルボキシル基。
カルボキシル基の化学式は-COOHです。
代用品
カルボニル。
カルボニル基は、さらに2つの原子または原子団に結合することができる。
カルボキシル基。
カルボキシル基は、さらに1つの原子または原子団に結合することができる。
極性
カルボニル カルボニル基は、酸素原子と炭素原子の間に電荷分離があるため、極性を持つ。
カルボキシル。
カルボニル基は、そのカルボニル基に極性を持つ。
プロトン放出
カルボニル カルボニル基はプロトンを放出できない。
カルボキシル。
カルボキシル基はプロトンを放出することができる。
二量体形成
カルボニル カルボニル基は2量体を形成しない。
カルボキシル基。
カルボキシル基は2量体を形成する。
水素結合
カルボニル カルボニル基は水素結合を形成できない。
カルボキシル基。
カルボキシル基は、水素結合を形成することができる。
例
カルボニル 最も単純なカルボニル化合物はアルデヒドとケトンです。
カルボキシル。
カルボキシル基を持つ主な化合物はカルボン酸です。
結論
カルボニル基とカルボキシル基は、有機化合物の特徴的な性質を担っている2つの有機官能基です。
カルボニル基とカルボキシル基の主な違いは、カルボニル基が炭素原子と酸素原子の二重結合からなるのに対し、カルボキシル基はカルボニル基と水酸基がカルボニル基の炭素原子を介して互いに結合したものであることです。
