主な違い – クロロベンゼン vs 塩化ベンジル
クロロベンゼンと塩化ベンジルという名称は紛らわしいですが、2つの異なる化合物の名称として使用されている用語です。
どちらも異なる置換基で置換されたベンゼン環を含むので、芳香族化合物です。
両者は、後述するように化学的、物理的性質が異なる。
クロロベンゼンと塩化ベンジルの大きな違いは、クロロベンゼンは塩素原子がベンゼン環に直接結合しているのに対し、塩化ベンジルは塩素原子がベンゼン環に間接的に(-CH2基を介して)結合していることである。
クロロベンゼンとは?
クロロベンゼンは、化学式C6H5Clで表される有機化合物です。
ベンゼン環の水素原子1個を塩素原子に置き換えたもので、芳香族化合物です。
芳香族化合物です。
室温では無色の可燃性液体です。
クロロベンゼンの一般名は塩化ベンゼンという。
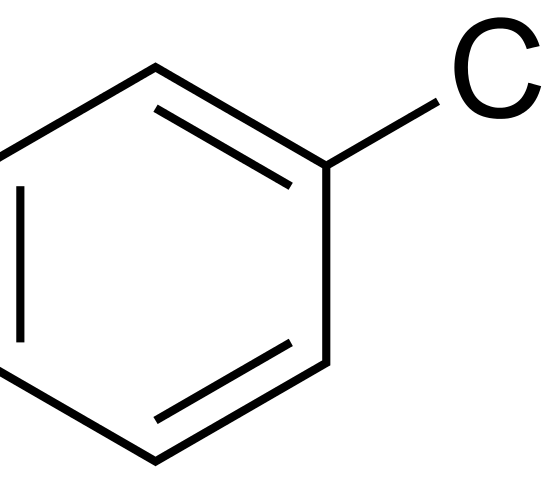 :図1 クロロベンゼンの化学構造
:図1 クロロベンゼンの化学構造
クロロベンゼンのモル質量は112.56g/molです。
アーモンドに似た臭いがあります。
融点は-45℃、沸点は131℃です。
この化合物は、ほとんどの有機溶媒に溶ける。
しかし、水には不溶です。
クロロベンゼンの蒸気は、通常の空気より重い。
クロロベンゼンは、除草剤、殺虫剤、ゴムなどの製造の中間体として使用される。
また、沸点が高いため、高沸点溶剤として様々な産業で使用されている。
しかし、クロロベンゼンの毒性は低〜中程度です。
塩化ベンジルとは
塩化ベンジルは、化学式C7H7Clで表される芳香族有機化合物です。
トルエンのメチル基の水素原子を塩素原子に置き換えたものです。
室温では無色(微黄色)の液体で、刺激臭があります。
ベンジル基を持つことから塩化ベンジルと呼ばれる。
塩化ベンジルのモル質量は126.58g/molです。
塩化ベンジルの融点は-39 ℃、沸点は179 ℃です。
水にはごくわずかに溶けるが、有機溶媒にはよく溶ける。
塩化ベンジルのIUPAC名はクロロメチルベンゼンです。
塩化ベンジルは、主にトルエンと塩素ガスとの光化学反応によって生成される。
ここで、副産物としてHClが生成される。
この反応はフリーラジカルプロセスです。
塩化ベンジルは、ベンジルエステルやベンジルエーテルの製造の前駆体です。
また、この化合物は塩化ベンジルと金属マグネシウムを反応させてグリニャール試薬の製造に利用できる。
クロロベンゼンと塩化ベンジルの違い
定義
クロロベンゼン。
クロロベンゼンは、化学式C6H5Clで表される有機化合物です。
塩化ベンジル。
塩化ベンジルは、化学式C7H7Clを有する芳香族有機化合物です。
塩素原子の位置
クロロベンゼン クロロベンゼンは、ベンゼン環に直接塩素原子が結合している。
塩化ベンジル。
塩化ベンジルは、塩素原子がベンゼン環に間接的に結合している(-CH2基を介して結合している)。
モル質量
クロロベンゼン クロロベンゼンのモル質量は112.56g/molです。
塩化ベンジル。
塩化ベンジルのモル質量は、126.58g/molです。
融点・沸点
クロロベンゼン クロロベンゼンの融点は-45 ℃、沸点は131 ℃です。
塩化ベンジル。
塩化ベンジルの融点は-39 °C、沸点は179 °C。
臭気
クロロベンゼン クロロベンゼンは、アーモンドのような臭いがする。
塩化ベンジル 塩化ベンジルの刺激臭。
水溶性
クロロベンゼン クロロベンゼンは、水溶性ではない。
塩化ベンジル。
塩化ベンジルは、ごくわずかに水溶性です。
結論
クロロベンゼンと塩化ベンジルは、化学構造上ベンゼン環を含む芳香族有機化合物です。
クロロベンゼンと塩化ベンジルの主な違いは、クロロベンゼンはベンゼン環に塩素原子が直接結合しているのに対し、塩化ベンジルはベンゼン環に塩素原子が間接的(-CH2基を介して結合)に結合している点です。
