主な相違点 – S軌道 vs P軌道
原子は、原子核のまわりを縦横無尽に動き回る電子で構成されています。
電子は原子核の周りを動いているため、ある瞬間にその電子の正確な位置を特定することはできません。
ある位置に電子がいる確率を推測するしかない。
この現象を「ハイゼンベルグの不確定性原理」といいます。
この確率に従って、最も高い確率で電子が存在できる領域を軌道という言葉で説明します。
原子核の周りの電子のエネルギーや動きによって、異なる軌道が存在することがあります。
S軌道とP軌道がそれです。
S軌道とP軌道の主な違いは、S軌道が球状であるのに対し、P軌道はダンベル状であることです。
Sオービタルとは
S軌道は、球状の形状をした原子軌道です。
他の原子軌道と比較して、最もエネルギーが低い。
各電子殻には少なくとも1つのS軌道が存在する。
S軌道は、他の軌道の中で最も単純な原子軌道です。
1つのS軌道は最大2個の電子を保持することができる。
S軌道には副軌道がない。
sは “シャープ “を意味する。
この軌道は、その軌道にある電子の角運動量を考慮して、このような名前が付けられた。
原子軌道は一定のエネルギー準位で構成されているため(エネルギーは量子化されている)、量子数が与えられている。
S軌道には、原子の角運動量量子番号が割り当てられています。
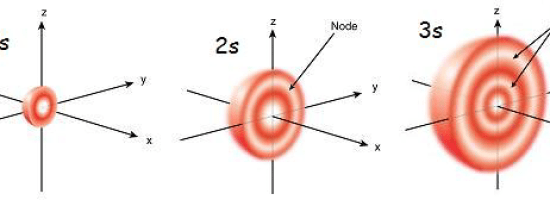
図1: S軌道の大きさは、原理量子数の増加とともに大きくなる。
S軌道の2つの電子は、それぞれ逆のスピンを持っています。
S軌道は化学結合に関与している。
シグマ結合の形成に関与することができる。
しかし、このS軌道はπ結合を形成することができない。
球形の形状は、電子が最も多く存在する領域を示している。
S軌道には角の節がない。
したがって、S軌道の角運動量量子数は0です。
S軌道は、同じ電子殻にある他の軌道の中で最もエネルギーが低い軌道です。
より高い電子殻(主量子数=n)では、s軌道は最も近い下位殻(n-1)のd軌道よりも低いエネルギーとなる。
s軌道の球の大きさは、主量子数が大きくなるにつれて大きくなる。
Pオービタルとは
P軌道は、ダンベル型の原子軌道です。
P軌道はS軌道よりも高いエネルギーを持っています。
pは “principal “の略。
p軌道にある電子の角運動量を表している。
1つのp軌道には、最大6個の電子を入れることができる。
これらの電子は素粒子軌道を占有しています。
1つの素粒子軌道は最大2個の電子しか保持できない。
したがって、1つのp軌道は3つの部分原子軌道を持つことになります。
これらはpx, py, pzと名付けられる。
一般に、これらをまとめてp軌道と呼ぶ。
 : 図2: 3つのP軌道の形と向き
: 図2: 3つのP軌道の形と向き
p軌道の3つの副軌道は、原子の中での軌道の向きによって、それぞれ異なる。
しかし、その形状は似ている。
これらの副軌道はすべてダンベル型です。
p軌道の特殊な点は、角の節で構成されていることです。
したがって、p軌道の角運動量量子数は1です。
主量子数1を持つ電子殻以外は、すべてp軌道で構成されています。
p軌道の大きさは、主量子数が大きくなるにつれて大きくなる。
1つのp軌道には2つのローブがあります。
これらのローブは軸にそって対称です。
これらのp軌道は化学結合に関与している。
シグマ結合とπ結合のいずれかを形成することができる。
水平方向にあるP軌道はシグマ結合を形成することができます。
他の2つのサブ軌道は、π結合に関与している。
S軌道とP軌道の類似性
- S軌道とP軌道は、原子軌道の一種です。
- S軌道とP軌道は原子軌道の一種で、どちらも軌道上の電子の角運動量を表す。
- どちらの軌道もシグマ結合に関与している。
S軌道とP軌道の違い
定義
S軌道。
S軌道は、球状の原子軌道。
P軌道。
ダンベル型の原子軌道。
エネルギーレベル
S軌道。
S軌道は最も低いエネルギー準位です。
P軌道。
P軌道はS軌道よりエネルギーが高い。
アンギュラーノード
S軌道:S軌道は角の節がない。
P軌道:P軌道には角度ノードがあります。
最大電子数
S軌道。
S軌道が保持できる電子の最大数は2個です。
P軌道。
P軌道が保持できる最大電子数は6個。
サブオービタル
S軌道。
S軌道にはサブ軌道は存在しない。
P軌道。
P軌道には3つのサブ軌道があります。
角運動量量子数
S軌道 S軌道の角運動量量子数は0です。
P軌道。
P軌道の角運動量量子数は1です。
ローブ
S軌道。
S軌道にはローブはない。
P軌道。
P軌道にはローブが存在する。
結論
S軌道、P軌道ともに原子軌道です。
これらの軌道は、その原子の電子を見つけることができる最も可能性の高い領域を示しています。
s軌道とp軌道の主な違いは、s軌道が球状であるのに対し、p軌道はダンベル状であることです。
