主な違い – シェル vs サブシェル vs オービタル
原子は、物質を構成する基本単位です。
かつて科学者たちは、原子はそれ以上分割できないと信じていました。
しかし、その後の発見で素粒子に関する情報が明らかになり、原子がさらに素粒子に分割できることが示されました。
電子、陽子、中性子の3つが主な素粒子です。
陽子と中性子が一緒になって、原子の中心核である原子核をつくっています。
電子はこの原子核のまわりを絶えず動いている。
電子の位置を正確に特定することはできませんが、電子は一定の経路で動いています。
殻、副殻、軌道という用語は、電子が移動できる最も可能性の高い経路を指す。
殻と副殻と軌道の大きな違いは、殻は同じ主量子数の電子、副殻は同じ角運動量量子数の電子で構成されるのに対し、軌道は同じエネルギー準位にありながら異なるスピンを持つ電子で構成されることである。
シェルとは
原子核の周りにある電子の通り道を殻と呼びます。
殻の中の電子が構成するエネルギーによって原子核の周りに配列されているため、エネルギー準位とも呼ばれます。
原子核に最も近いところにあるのが、最もエネルギーの低い殻。
その殻の先にあるのが次のエネルギー準位です。
これらの殻を見分けるために、K、L、M、Nなどの名前がつけられています。
最もエネルギーの低い殻はK殻です。
しかし、科学者はこれらの殻に量子数で名前をつけています。
しかし、科学者たちはこれらの殻に量子番号をつけています。
この殻につけられた量子数を主量子数と呼びます。
最も低いエネルギー準位の殻は、n=1です。
すべての殻が同じ数の電子を保持するわけではありません。
最も低いエネルギー準位では、最大2個の電子しか保持できません。
次のエネルギー準位では、最大8個の電子を保持することができます。
1つの殻が保持できる電子の数にはパターンがあります。
このパターンを以下に示します。
| 主量子数(n) |
| n=5 | 32 |
| n=6 | 32 |
したがって、どの殻も保持できる電子の最大数は32個です。
どの殻も32個以上の電子を持つことはできません。
高い殻は低い殻より多くの電子を保持することができます。
このような殻の存在は、原子のエネルギーが量子化されていることを示します。
つまり、原子核のまわりを動き回る電子のエネルギーが離散的に存在するのです。
この殻の中の電子は、エネルギーを吸収したり放出したりすることで、ある殻から別の殻に移動することができる。
エネルギーを吸収または放出する量は、2つの殻の間のエネルギー差に等しくなければならない。
そうでなければ、この遷移は起こりません。
サブシェルとは
電子が殻の中を移動する領域のことです。
角運動量量子数によって名前が付けられています。
殻の中にある副殻は、大きく分けて4種類あります。
それぞれの副殻は、いくつかの軌道から構成されています。
各副殻は複数の軌道から構成されます。
副殻に含まれる軌道の数は次のとおりです。
| サブシェル|軌道の数|電子の最大数|を示します。 | ||
| s | 1 | 2 |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
また、これらの副殻は、構成するエネルギーによって並べられる。
低い殻では、サブシェルのエネルギーの昇順は、s<p<d<f のようになります。
しかし、高次の殻では、この順序は異なります。
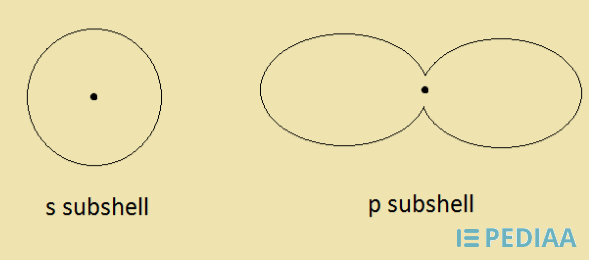 図02: 副殻の形状
図02: 副殻の形状
s殻は球状、p殻はダンベル状と、それぞれユニークな立体構造を持っています。
これらの形状は上に示したとおりです。
オービタルとは
軌道とは、電子の波動的な振る舞いを記述する数学的な関数です。
つまり、軌道という言葉は、電子の正確な動きを説明しているのです。
サブシェルは軌道の集合体です。
サブシェルが持つ軌道の数は、サブシェルに依存する。
つまり、サブシェルに存在する軌道の数は、サブシェルに固有の特徴です。
| サブシェル|軌道の数||||||。 | |
| s | 1 |
| p | 3 |
| d | 5 |
| f | 10 |
しかし、1つの軌道には最大2個の電子しか保持できません。
これらの電子は同じエネルギー準位にありますが、スピンによって互いに異なっています。
それらは常に反対のスピンを持っています。
電子が軌道に充填されるとき、フントの法則に従って充填される。
この法則は、軌道が二重に結合する前に、副殻のすべての軌道が電子で一重に占有されることを示している。
図3:d軌道の形状
上の図は、d 軌道の形状です。
1つのdサブシェルは5つの軌道から構成されているので、上の図は5つの異なる軌道の形状を示している。
シェル サブシェルとオービタルの違い
定義
シェル。
シェルとは、原子の原子核の周りにある電子の通り道のことです。
サブシェル。
電子がシェル内を移動する経路。
軌道(Orbital) 電子の波動的な振る舞いを記述する数学的関数。
量子数の名称
シェルのこと。
シェルには主量子数が与えられる。
サブシェル サブシェル:角運動量量子数
軌道 軌道には磁気量子数が与えられる。
最大電子数
シェルのこと。
1つのシェルには最大32個の電子を入れることができる。
サブシェル サブシェルの種類によって、保持できる電子の最大数は異なる。
軌道。
軌道の最大電子数は2個。
結論
原子は、電子、陽子、中性子で構成されています。
陽子と中性子は原子核の中にあります。
電子は原子核の周りに雲を形成している。
この電子の雲には、常に動いている電子があります。
さらに発見が進むと、これは単なる雲ではないことが分かってきました。
電子が移動するエネルギー準位が量子化されているのです。
電子が動く道筋のようなものです。
この経路を表現するために、シェル、サブシェル、オービタルという用語が使われています。
殻と副殻、軌道の大きな違いは、殻は主量子数が同じ電子、副殻は角運動量量子数が同じ電子で構成されているのに対し、軌道は同じエネルギー準位にありながらスピンが異なる電子で構成されている点です。
