主な相違点 – 共有結合と極性共有結合
化合物には、さまざまな種類の化学結合があります。
共有結合はそのような化学結合です。
共有結合は、2 つの原子がその不対電子を互いに共有することによって形成されます。
不対電子を保持することは、原子にとって安定した状態ではない。
そのため、原子の周りの電子配置に従うために共有結合を形成するのです。
共有結合には、極性結合と非極性結合があります。
共有結合と極性共有結合の主な違いは、共有結合は極性にも非極性にもなるのに対し、極性共有結合は基本的に極性であることです。
共有結合とは
原子間の不対電子の共有によって形成される化学結合、あるいは原子同士が共有結合で結ばれた化合物の名称として共有結合という言葉が使われる。
共有結合は、2つの原子が安定な電子配置を得るために、互いに不対電子を共有することで形成される。
電子配置の八分則によれば、水素以外の原子は8個の価電子に囲まれるまで結合を形成する傾向があります。
したがって、原子は八分則に従うために、イオン結合か共有結合のどちらかを形成する。
共有結合を形成する場合、2個の電子は両方の原子で共有される。
例えば、基底状態の炭素原子は4個の価電子を持っている(価電子とは、原子の最も外側の軌道にある電子のこと)。
電子配置を完成させるために、炭素原子はその4個の電子を別の4個の電子と共有する(不対)。
最も簡単な例は、メタンです。
メタンでは、4つの水素原子が1つの炭素原子と不対電子を共有し、4つの共有結合を形成している。
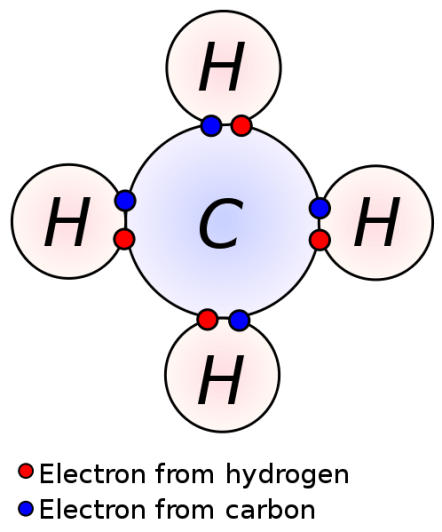 : 図1: メタン分子における4つの共有結合
: 図1: メタン分子における4つの共有結合
共有結合化合物とは、共有結合で結ばれた原子からなる化合物です。
このような化合物には分子とイオンがあります。
共有結合は、極性または非極性のいずれかになります。
また、共有結合には単結合、二重結合、三重結合があります。
単結合はシグマ結合です。
二重結合と三重結合は、シグマ結合とともにπ結合で構成されています。
極性共有結合とは?
極性共有結合とは、極性を持つ共有結合を指す言葉です。
共有結合には、極性共有結合と非極性共有結合の2種類があります。
非極性共有結合は、2つの原子が等しい電子対を共有するときに形成される。
極性共有結合は、2つの原子が電子を不均等に分配しているときに形成される。
電子の分布が不均等なため、共有結合はわずかに電荷分離を起こす。
すると、共有結合の一方の端はデルタ正の電荷を持ち、もう一方の端はデルタ負の電荷を持つことになります。
これがダイポールモーメントと呼ばれるものです。
このように2つの原子の間で電子の分布が不均等になる原因は、原子の電気陰性度の違いにある。
電気陰性度の異なる2つの原子が共有結合している場合、結合電子はもう一方の原子よりも電気陰性度の高い原子の方に引き寄せられる。
例えば、CとOの共有結合では、炭素原子にデルタ正電荷が、酸素原子にデルタ負電荷が発生します。
これは、Oの電気陰性度が3.44で、炭素の場合は2.55であるためです。
共有結合と極性結合の違い
定義
共有結合。
共有結合とは、原子間の不対電子の共有によって形成される化学結合、または共有結合によって互いに結合した原子からなる化合物を指す。
極性共有結合。
極性共有結合とは、極性を持つ共有結合を指す言葉です。
極性
共有結合です。
共有結合は極性または非極性になる。
極性共有結合。
極性共有結合は極性を持つ。
電荷分離
共有結合。
共有結合は、電子的な電荷分離があってもなくてもよい。
極性共有結合。
極性共有結合は、わずかな電荷分離を示す。
双極子モーメント
共有結合。
共有結合は、双極子モーメントを示す場合と示さない場合があります。
極性共有結合。
極性共有結合は双極子モーメントを示す。
結論
共有結合は、2 つの原子がその不対電子を互いに共有することによって形成されます。
共有結合は極性または非極性のいずれかになります。
共有結合と極性共有結合の主な違いは、共有結合が極性または非極性であるのに対し、極性共有結合は本質的に極性であることです。
