主な違い – 原子構造と結晶構造
原子はあらゆる物質の中に存在する最小の単位ですが、実験的に分析すると複雑な構造を持っています。
化学のほぼすべての概念を理解するためには、原子の基本構造を明確に理解することが不可欠です。
結晶は、多数の原子や分子でできた固体の化合物です。
結晶には特定の配列があります。
このような配置を結晶構造と呼びます。
結晶構造を調べることは、その化合物の性質を決定する上で非常に重要です。
原子構造と結晶構造の主な違いは、原子構造が原子中の素粒子の配列を表すのに対し、結晶構造は結晶性化合物中の原子または分子の配列を表すことです。
原子構造とは
原子構造とは、原子の中にある素粒子の配列のことです。
以前は、原子は地球上に存在する最小の単位であり、すべての物質は原子で構成されていると考えられていましたが、その後の実験により、原子はさらに素粒子に分割できることが証明されました。
そこで、原子の構造という概念が議論されるようになった。
科学者によって、原子の構造はさまざまに提案された。
しかし、科学技術の発展とともに、原子の構造を明確に説明する現代原子論が開発された。
現代原子論によると、原子は電子、陽子、中性子という3種類の素粒子で構成されている。
陽子と中性子は原子の真ん中にあり、原子核と呼ばれる中心核を形成している。
電子は原子核の周りを特定の経路で連続的に移動している。
しかし、これらの電子は原子核を取り囲む電子雲のように見えます。
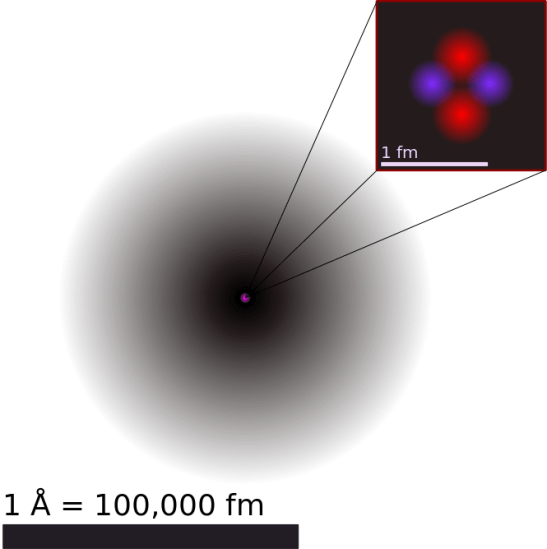 : 図1: ヘリウムの原子構造
: 図1: ヘリウムの原子構造
電子は原子核の周りを絶えず動いているため、一度に正確な位置を特定することはできません。
ある場所に電子が存在する確率を言うしかない。
この確率に従って、電子が移動する殻が決まっています。
この殻は、それぞれ量子化されたエネルギー準位を持っています。
したがって、これらの殻は、その殻に存在する電子のエネルギー準位に従って配置されている。
エネルギーが最も低い殻が原子核に最も近い殻となります。
これらの電子殻は、原子核から外側に向かって、K、L、M、Nなどと名づけられる。
電子殻は、さらに副殻に分けることができます。
これらの副殻は、s副殻、p副殻、d副殻、f副殻と名付けられます。
s殻以外の殻は、さらに軌道に分けることができます。
各軌道には、スピンが逆向きの電子を最大2個まで入れることができる。
電子は、化学反応に関与する主要な素粒子です。
しかし、核反応には陽子と中性子が関与する。
結晶構造とは
結晶構造とは、結晶中の原子や分子の配列のことである。
固体化合物は、結晶性化合物、半結晶性化合物、非結晶性化合物の3つに分類される。
結晶性化合物は、整然とした構造を持っています。
3次元的な構造を持っています。
結晶性化合物の結晶構造は、格子と呼ばれる。
この組織化された構造の最小単位を単位胞という。
この単位セルは、結晶の全体的な配置を表しているはずです。
単位胞の構造には、大きく分けて3つの構造が提案されている。
単純立方体構造、体心立方体構造、面心立方体構造です。
結晶の構造を考えるとき、結晶には7つの構造があり、その対称性によって名前がつけられている。
単斜晶、三斜晶、三角晶、六方晶、斜方晶、正方晶、立方晶です。
図2: NaClの結晶構造
さらに、結晶中に存在する化学結合の種類によって名前が付けられた結晶構造もあります。
イオン結晶、共有結合性ネットワーク結晶、金属結晶です。
イオン結晶は、陽イオンと陰イオンが規則正しく繰り返し配列したものです。
共有結合性ネットワーク結晶は、原子や分子が共有結合によって互いに結合し、ネットワークを形成しているものです。
金属結晶は、自由に動く電子に囲まれた金属カチオンで構成されています。
原子構造と結晶構造の違い
定義
原子構造。
原子構造とは、原子の中にある素粒子の配列のことである。
結晶構造。
結晶構造とは、結晶中の原子や分子の配列のことである。
構造
原子構造。
原子構造は複雑な構造です。
結晶構造。
結晶構造は、整然とした格子構造です。
コンポーネント
原子の構造。
原子は、電子、陽子、中性子の素粒子で構成されている。
結晶構造。
結晶は陽イオンと陰イオン、または金属イオンと自由電子から構成されている。
バリエーション
原子構造。
全体的な原子構造はすべての原子で同じです。
結晶構造。
結晶構造は、結晶中に存在する成分によってそれぞれ異なる。
結論
原子構造は、化学のすべてを理解する上で重要です。
結晶構造は、結晶を特定し、結晶の特性を理解し、その反応を予測するために重要です。
原子構造と結晶構造の主な違いは、原子構造が原子中の素粒子の配列を表すのに対し、結晶構造は結晶性化合物中の原子や分子の配列を表すことである。
