主な相違点 – 結合極性 vs 分子極性
化学では、極性は分子を双極子モーメントに導く電荷の分離です。
ここでは、結合または分子のいずれかにおいて、部分的に正と負の電荷が分離しています。
これは、主に原子の電気陰性度の違いによって起こる。
原子の電気陰性度とは、電子の引き合う度合いを示す指標です。
2つの原子が共有結合で結ばれると、結合電子は最も電気陰性な原子の方に引き寄せられる。
これにより、この原子は周囲の電子密度が高くなり、部分的に負の電荷を帯びることになる。
これに対応して、他の原子は部分的に正電荷を帯びます。
最終的には極性結合となります。
これは結合極性によって表現されます。
分子極性は、分子全体の極性です。
結合極性と分子極性の主な違いは、結合極性が共有結合の極性を説明するのに対し、分子極性は共有結合分子の極性を説明することです。
Bond Polarityとは
結合極性とは、共有結合の極性を説明する概念です。
共有結合は、2つの原子がその不対電子を共有することによって形成されます。
そして、結合電子や結合に関与する電子は、両方の原子に属している。
したがって、2つの原子の間に電子密度が存在することになる。
2つの原子が同じ化学元素の場合、どちらの原子も結合電子に等しい引力を示すので、結合極性は観察されない。
しかし、2つの原子が異なる化学元素に属している場合、電気陰性度の高い原子が電気陰性度の低い原子よりも結合電子を引き寄せることになります。
すると、電気陰性度の低い原子は、その原子の周りの電子密度が減少するため、部分的に正電荷を帯びることになります。
しかし、より電気陰性な原子は、その原子の周りの電子密度が高いので、部分的に負の電荷を得る。
この電荷分離は、共有結合における結合極性として知られている。
電荷分離がある場合、その結合は極性結合と呼ばれる。
また、結合極性がない場合は、非極性結合と呼ばれます。
結合極性を理解するために、2つの例を考えてみましょう。
ボンド極性の例
CF
ここで、CはF原子より電気陰性度が低い。
したがって、結合電子はF原子の方に引き寄せられます。
このとき、F原子は部分的に負電荷を帯び、C原子は部分的に正電荷を帯びる。
H2
ここで、2つのH原子は共有結合で互いに結合している。
両原子の電気陰性度が同じであるため、一方の原子による正味の引力は存在しない。
したがって、これは電荷分離のない非極性結合です。
分子極性とは
分子極性とは、共有結合性化合物の極性を説明する概念です。
ここでは、分子内の電荷分離を総合的に考える。
その際、分子内に存在する一つ一つの共有結合の極性が利用される。
分子極性によって、化合物は極性化合物と非極性化合物に分類される。
分子極性は、分子に双極子モーメントを発生させる。
分子の双極子モーメントとは、2つの反対電荷が分離して双極子が成立することである。
分子極性は主に分子形状に依存する。
分子の形状が対称的であれば、正味の電荷分離は起こらない。
しかし、分子形状が非対称であれば、正味の電荷分離が起こる。
この概念を説明するために、例を挙げてみよう。
分子極性の例
H2O
水分子は電荷分離により双極子モーメントを持つ。
そこでは、酸素は水素原子よりも電気陰性度が高い。
そのため、結合電子は酸素原子に引き寄せられやすい。
水分子の分子構造は、三角形の平面という非対称な形状をしている。
したがって、水分子は分子極性を示す。
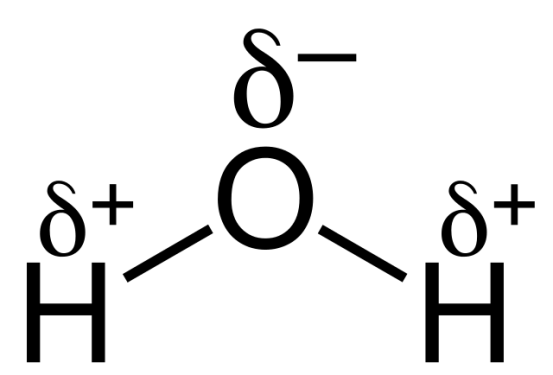 :図2 H2O
:図2 H2O
二酸化炭素
この分子は2つの極性C=O結合を持っています。
しかし、分子形状は直線的です。
そうすると、正味の電荷分離がない。
したがって、CO2は無極性分子です。
結合極性と分子極性の違い
定義
結合極性。
結合極性は、共有結合の極性を説明する概念です。
分子極性。
分子極性は、共有結合の極性を説明する概念です。
極性に影響を与える要因
結合極性。
結合極性は、結合に関与する原子の電気陰性度の値によって決まる。
分子極性。
分子極性は、主に分子の幾何学的形状に依存する。
異なるタイプ
結合極性。
結合極性:極性共有結合と非極性共有結合が形成される。
分子極性。
分子極性:極性を持つ共有結合と非極性を持つ共有結合が形成される。
結論
結合や分子の極性は、電荷の分離を説明する概念です。
結合の極性は、原子の電気陰性度の違いによって生じます。
分子極性は、主に分子の形状に依存する。
しかし、結合極性と分子極性の主な違いは、結合極性が共有結合の極性を説明するのに対し、分子極性は共有結合分子の極性を説明することです。
