極性は共有結合の分子で発生します。
共有結合は、同じ元素または異なる元素の2つの原子が電子を共有し、各原子が希ガスの電子配置を達成するときに形成されます。
これらの共有結合は極性または非極性になります。
この記事では、以下のことを説明します。
極性とは
分子の極性は、融点、沸点、表面張力、蒸気圧など、分子の他の物理的特性を規定する。
簡単に言うと、極性は分子内の電子分布が非対称である場合に発生します。
その結果、分子内に正味の双極子モーメントが発生する。
分子の一端はマイナスに帯電し、他端はプラスに帯電する。
分子の極性の主な原因は、共有結合に参加する2つの原子の電気陰性度です。
共有結合では、2つの原子が一緒になって一対の電子を共有します。
共有された一対の電子は、両方の原子に属している。
しかし、原子の電子に対する吸引力は元素によって異なる。
例えば、酸素は水素よりも電子に対する吸引力が強い。
これを電気陰性度といいます。
結合を形成する2つの原子の電気陰性度の差が0.4<の場合、2つの原子が共有する一対の電子は、電気陰性度の高い原子の方に引き寄せられます。
その結果、電気陰性度の高い方の原子がわずかに負に帯電し、もう一方の原子がわずかに正に帯電することになる。
このような場合、分子は分極しているとみなされます。
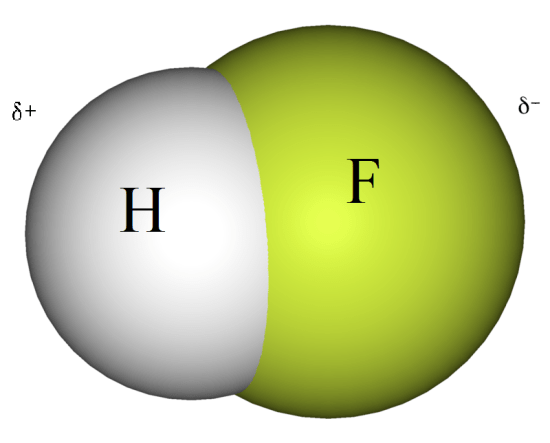 :図1 フッ化水素分子
:図1 フッ化水素分子
フッ化水素分子の負電荷の大きいF原子がわずかに負電荷を帯び、H原子がわずかに正電荷を帯びる。
この結果、分子内に正味の双極子モーメントが発生する。
分子形状が極性に与える影響
分子の分極は、分子の形状に大きく依存します。
前述のHFのような2原子分子は形状の問題はない。
正味の双極子モーメントは、2つの原子の間の電子の偏在によるものだけです。
しかし、結合を作るのに関与する原子が2つ以上になると、いろいろと複雑な問題が出てくる。
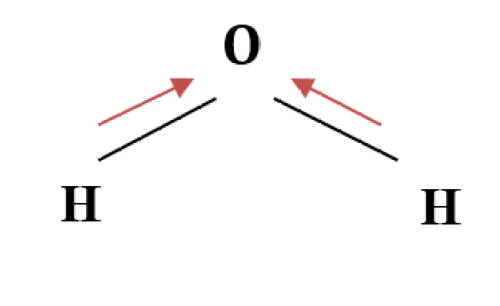
極性の強い水分子を例にとって見てみよう。
図2:水分子
水分子は曲がった形をしている。
そのため、酸素が共有する2個の電子と2個の水素原子のペアが酸素側に引っ張られると、正味の双極子モーメントが酸素原子の方向に働くことになる。
その結果生じる双極子モーメントを打ち消す力は、他にはない。
このように、水分子は強い極性をもっている。
 :図3 アンモニア分子
:図3 アンモニア分子
アンモニア分子はピラミッド型で、電気陰性であるN原子が電子を自分自身に引き寄せている。
3つのN-H結合は同一平面上にないため、発生する双極子モーメントが相殺されない。
このため、アンモニアは極性分子となる。
しかし、分子の形によって双極子モーメントが打ち消され、非極性になることがあります。
二酸化炭素はそのような分子です。
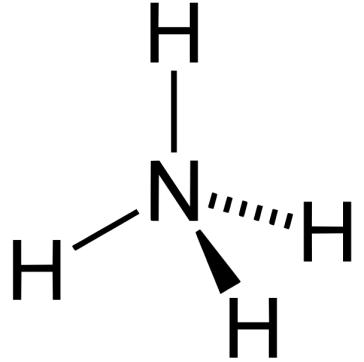 図4: 二酸化炭素分子
図4: 二酸化炭素分子
C原子とO原子の電気陰性度の差は1.11であり、電子はO原子に多く偏っている。
しかし、二酸化炭素分子は平面的な線状です。
3つの原子はすべて同じ平面上にあり、Cは2つのO原子の真ん中に位置しています。
C-O結合の双極子モーメントは、2つの結合が反対方向にあるため、もう一方の結合と相殺され、二酸化炭素分子を無極性にしている。
電気陰性度の差は十分あったとしても、分子の極性を決定する上で形状は重要な役割を果たす。
四塩化炭素の極性も、これと同じようなシナリオです。
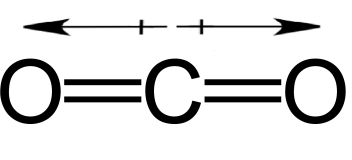 図5: 四塩化炭素分子
図5: 四塩化炭素分子
炭素と塩素の電気陰性度の差は、C-Cl結合が極性を持つのに十分です。
CとClの間に共有される一対の電子は、Cl原子のほうに多く存在する。
しかし、四塩化炭素分子は対称的な四面体であるため、結合の正味の双極子モーメントが相殺され、結果として正味の双極子モーメントはゼロとなる。
そのため、この分子は無極性になる。
- “Hydrogen-fluoride-3D-vdW” ByBenjah-bmm27- Own work assumed (based on copyright claims) (Public Domain) via Commons Wikimedia
- “アンモニウム-2D” By Lukáš Mižoch – 自作 (Public Domain) via Commons Wikimedia
- 「二酸化炭素” (パブリックドメイン) via Commons Wikimedia
- 「四塩化炭素-3Dボール” (パブリックドメイン) via Commons Wikimedia
- “四塩化炭素の分子は非極性なのに、その中の結合はなぜ極性なのですか?” Socratic.org. N.p., n.d. Web. 13 Feb. 2017.
- “アンモニアは極性か?” リファレンス・ドット・コム.N.p., n.d. Web. 13 Feb. 2017.
- Ophardt, Charles E. “Molecular Polarity.”. 仮想チェンブック。エルムハーストカレッジ、2003年。Web. 13 Feb. 2017.
