
主な違い – 分子間力 vs 分子内力
分子間力と分子内力は、個々の分子や原子を結びつけている2種類の力です。
これらの力は、分子や原子の動きを制御しています。
どちらの力も、物質の化学的・物理的特性を決定する。
分子間力と分子内力の主な違いは、分子間力が分子自体の間に存在するのに対し、分子内力は分子内の原子の間に存在することです。
さらに、これらの力の間には多くの違いがあります。
今回はその検証を行う。
-
分子間力とは何か?
– 定義、特徴、特性 -
分子内力とは何か?
– 定義、特徴、特性 -
分子間力と分子内力の違いは何ですか?
分子間力とは?
分子間力とは、物質中の個々の分子がプラスとマイナスの電荷によって結合する力です。
分子間力は引力であるが、化学結合ではない。
したがって、分子間力は分子内力よりはるかに弱い。
これらの力は、物質の物理的特性を決定する。
最も重要な物理的特性の1つは、固体、液体、気体といった物質の状態を決定する能力です。
気体のランダムな運動や、液体や固体の分子をつなぎ合わせることで、液体や固体が存在するのは、これらの力のおかげです。
したがって、分子間力によって物質の融点や沸点が決まる。
融点や沸点は分子間力の強さに比例する。
つまり、融点や沸点が高いほど分子間力が強い。
ある温度で、気体、液体、固体の分子間力の強さは次のようになる。
気体 < 液体 < 固体
分子間力には、双極子-双極子力、ロンドン分散力、水素結合力の3種類が知られています。
いずれも分子内の電子と原子核の配置から生じる電荷によって結合が起こる。
この3つのタイプのうち、水素結合は最も強い分子間結合です。
水分子は、分子の特定の位置に部分電荷があるため、水素結合で保持されている。
分子内力とは何か?
分子内で原子を保持する力を分子内力という。
この力が化学結合の形成に関与している。
したがって、分子内力は分子間力よりもはるかに強い。
分子内相互作用は、2つの原子が電子を共有したり、別の原子に電子を提供したり、別の原子から電子を獲得したりするときに起こる。
2つの原子の間で電子を共有する場合、その結合は共有結合と呼ばれます。
一方の原子が電子を与える/得る場合、その結合はイオン結合と呼ばれる。
分子内力は物質の化学的パラメータを決定する。
金属結合も分子内力の一種に分類される。
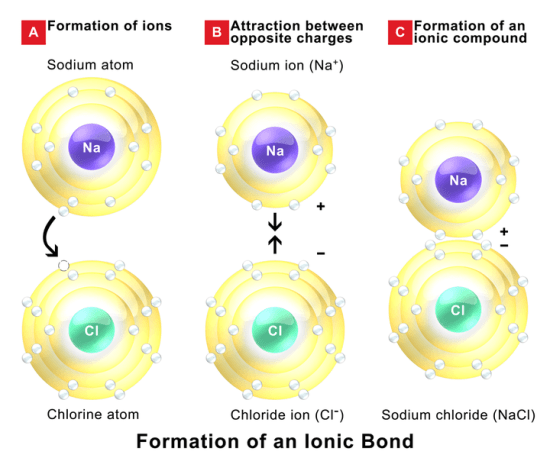
分子間力と分子内力の違い
定義
分子間力とは、物質中の分子を保持する力です。
分子内力とは、分子内の原子を保持する力です。
強さ
分子間力は分子内力より弱い。
分子内力は分子間力より強い。
物性値測定
分子間力は、物質の状態(固体/液体/気体)や融点・沸点などの物理的性質を決定する。
分子内力は、物質の化学的挙動を決定する。
力の性質
分子間力とは引力です。
分子内力は化学結合です。
例
分子間力は、双極子-双極子力、ロンドン分散力、水素結合力に分類される。
分子内力は、共有結合、イオン結合、金属結合に分類される。
“Ionic Bonds” By BruceBlaus – 自作 (CC BY-SA 4.0) via Commons Wikimedia
Myers, R. The Basics of Chemistry. N.p: Greenwood Publishing Group, 2003. 印刷物。
CliffsNotes AP Chemistry: with CD-ROM. Hoboken, NJ: Wiley, 2009. Print.
Kelter, P. B., M. D. Mosher, and A. Scott. 化学。
ロジャース、D.L.、S.R.グッド、およびD.W.バール。

