主な違い – 単原子イオンと多原子イオン
単原子と多原子という用語は、分子またはイオンの原子性を表します。
原子性とは、分子またはイオンの中に存在する原子の数のことです。
これが単原子イオンと多原子イオンの主な違いです。
単原子イオンが1つの原子で構成されているのに対し、多原子イオンは1つのイオンにつき2つ以上の原子で構成されています。
これらのイオンは、陽イオンにも陰イオンにもなります。
単原子イオンも多原子イオンも、電荷が反対のイオンと静電的な引力を持つことによってイオン化合物を形成することができます。
単原子イオンとは
単原子イオンとは、1つのイオンに1つの原子が含まれるイオンのことです。
陽イオンと陰イオンがあります。
一部の原子は、最外殻の電子から価電子を取り除くことでイオンを形成します。
このようなイオンは単原子カチオンです。
最外殻の電子を獲得してイオンを形成するものもあります。
これらは単原子アニオンと呼ばれます。
次の表は、1族と17族の元素が形成する単原子イオンを示しています。
| — | — |
| 単原子陽イオン | 単原子陽イオン
| Li+|F-|Li+|F-|F
| Na+| Cl-|| K
| K+ Br-
| Cs+ I-
単原子イオンしか形成できない元素もあります。
しかし、他の元素も同様に多原子イオンを形成することができます。
単原子イオンは、持っている価電子の数によって異なる電荷を持つことができます。
例えば、マグネシウム(Mg)は2族元素で、2個の価電子を持っています。
この2個の電子を取り除くと、MgはMg+2カチオンを形成することができます。
すると単原子陽イオンになります。
しかし、希ガスは原子が非常に安定で電子配置が完成しているため、単原子イオンになることはありません。
電荷が反対の2つの単原子イオンが結合することで、2原子分子を形成することができる。
このとき、陽イオンと陰イオンは静電気力によって互いに引き合う。
例えば、塩化ナトリウム(NaCl)は、ナトリウム単原子カチオンと塩化物単原子アニオンからできている。
多原子イオンとは
多原子イオンとは、1つのイオンが複数の原子で構成されているイオンのことです。
2原子イオン、3原子イオン、またはその逆の場合があります。
多原子イオンは数え切れないほど多く知られています。
これらのいくつかは生体内に存在し、天然に存在するイオンもあれば、合成されたイオンもあります。
これらは非常に有用な多原子イオンです。
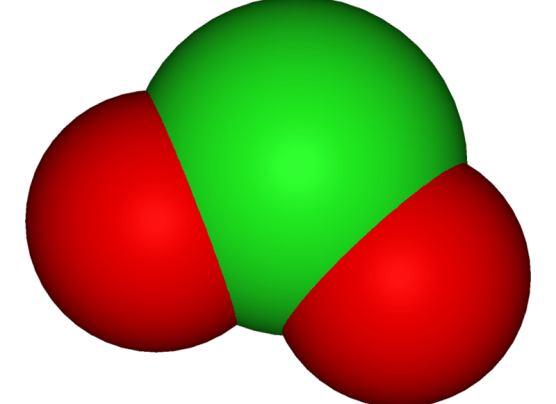 :図2: 三原子イオン
:図2: 三原子イオン
多原子イオンの原子は、互いに共有結合しています。
π結合だけでなく、シグマ結合もあります。
多原子イオンは、配位錯体として形成されることもあります。
ここでは、中心金属が中性電荷を持つ配位子によって取り囲まれています。
これらの配位子は、配位共有結合を介して中心金属イオンに結合している。
そして、この錯体は錯体イオンとみなされる。
このイオンの電荷は、中心金属イオンの電荷です。
それとは別に、何百もの多原子イオンが存在します。
これらはイオンの全体的な電荷によって陽イオンにも陰イオンにもなり得ます。
次の表は、そのいくつかを示しています。
| 多原子カチオン 多原子アニオン | |
| NH4+、CO32- | |
| H3O+|NO2-||||||||||||||||||||||||||。 | |
|
[Co(NH3)6]3+|HSO4-|」は
|
[Ni(H2O)6]2+、ClO4
単原子イオンと多原子イオンの違い
定義
単原子イオン。
単原子イオン: 1つのイオンに1つの原子を含むイオン。
多原子イオン。
1つのイオンに複数の原子が含まれるイオンで、多原子イオンと呼ばれる。
原子数
単原子イオン。
単原子イオン:1つのイオンにつき1つの原子で構成されている。
多原子イオン。
1つのイオンに複数の原子が含まれる。
フォーメーション
単原子イオン。
単原子イオンは、原子の最外殻の電子を失うか得るかによって形成される。
多原子イオン。
多原子イオンは、複数の原子が共有結合または配位共有結合で結合することで形成される。
化学結合
単原子イオン。
単原子イオンには化学結合はない。
多原子イオン。
多原子イオン: 共有結合または配位共有結合があります。
例
単原子イオン。
単原子イオンの例としては、Na+、K+、Cl-など。
多原子イオン。
多原子イオンの例としては、NH4+、NO2-、NO3-などが挙げられる。
結論
単原子イオンと多原子イオンは、そのイオンに含まれる原子の数によって名前が付けられています。
単原子イオンと多原子イオンの主な違いは、単原子イオンが1つの原子で構成されているのに対し、多原子イオンは1つのイオンが2つ以上の原子で構成されている点です。
