主な相違点 – 安定同位体と非安定同位体
同位体とは、同じ元素で原子構造が異なる原子のことです。
同じ元素の同位体は、同じ元素の異なる形態であるため、同じ原子番号を持っています。
しかし、原子核に含まれる中性子の数によって、互いに異なる。
元素の原子質量は、陽子の数と電子の数の和で決まります。
そのため、同位体の原子質量は互いに異なる。
同位体は主に安定同位体と不安定同位体の2つに分けられます。
安定同位体と不安定同位体の主な違いは、安定同位体は原子核が安定しているのに対し、不安定同位体は原子核が不安定であることです。
安定同位体とは
安定同位体とは、安定した原子核を持つ原子のことです。
原子核が安定しているため、放射線を発しない。
従って、安定した原子核は放射線を出しません。
ある元素は複数の安定同位体を持つことができます。
ウランのように、すべての同位体が不安定な元素もあります。
原子核の安定性を決めるのは、陽子と中性子の比率と、陽子と中性子の和の2つです。
魔法数」という現象は、最も安定な同位体の原子番号を説明する化学の概念です。
マジックナンバーは、陽子の数と中性子の数のどちらかを選ぶことができる。
特定の元素が魔法数の陽子または中性子を持つ場合、それらは安定同位体です。
マジックナンバー 2, 8, 20, 28, 50, 82
陽子: 114
中性子:126, 184がマジックナンバー。
さらに、陽子と中性子の数がともに偶数であれば、その同位体は安定である可能性が最も高い。
もう一つの方法は、陽子と中性子の比率を計算することです。
中性子数と陽子数のグラフがありますが、陽子数と中性子数の比を求めるのです。
そのグラフの安定同位体の領域に陽子と中性子の比が当てはまれば、その同位体は基本的に安定であると言えます。
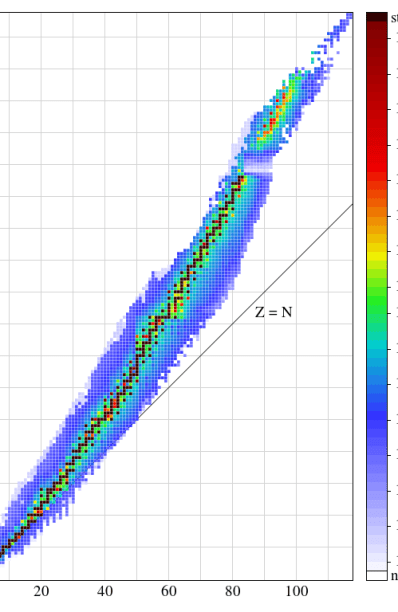 図1: 中性子数対陽子数のグラフ。
図1: 中性子数対陽子数のグラフ。
色のついた領域は安定帯と呼ばれる。
安定同位体は放射性物質ではありませんが、さまざまな用途に使われています。
例えば、水素には3つの主な同位体があります。
プロチウム、重水素、そしてトリチウムです。
プロチウムはその中で最も安定で、最も多く存在する同位体です。
トリチウムは最も不安定な同位体です。
重水素も安定ですが、自然界にそれほど多く存在しません。
しかし、プロチウムは、ほとんどどこにでもある同位体です。
重水素は実験用の重水として利用できます。
元素の中には、安定同位体が1つしかないものがあります。
このような元素はモノアイソトピックと呼ばれます。
モノアイソトピック元素は26種類知られています。
また、2つ以上の安定同位体を持つ元素もあります。
例えば、スズ(Sn)は10個の安定同位体を持っています。
安定しない同位体とは?
不安定同位体とは、原子核が不安定な原子のことです。
放射性同位元素です。
そのため、放射性同位元素とも呼ばれます。
ウランのように放射性同位体のみを持つ元素もあります。
他の元素は、安定同位体と不安定同位体の両方を持ちます。
不安定な元素は、いくつかの理由で不安定になることがあります。
陽子の数に比べて中性子の数が多いこともその一つです。
このような同位体では、安定な状態を得るために放射性崩壊が起こります。
ここで、中性子は陽子と電子に変換される。
これは以下のように与えられる。
10n → 11p + 0-1e
nは中性子、pは陽子、eは電子です。
粒子の質量は大文字の数字で、電荷は小文字の数字で示される。
同位体の中には、陽子の数が多いために不安定なものがあります。
ここで、陽子は中性子と陽電子に変換されることがあります。
陽電子は電子に似ていますが、電荷は+1です。
11P → 10N + 01E
ここで01eは陽電子を示す。
陽子が多すぎたり、電子が多すぎたりすることがあります。
これは、原子質量が非常に大きいことを示します。
すると、陽子2個と中性子2個がヘリウム原子として放出されます。
これをアルファ崩壊といいます。
放射性元素は、研究活動において多くの用途があります。
例えば、化石の年代測定、DNA解析、薬用などに利用されます。
不安定な同位体では、放射性崩壊は半減期で測定することができる。
半減期とは、ある物質が崩壊して最初の質量の2分の1になるまでの時間です。
安定同位体と非安定同位体の違い
定義
安定同位体。
安定同位体とは、安定した原子核を持つ原子のこと。
非安定同位体。
不安定な原子核を持つ原子。
放射能
安定同位体。
安定した同位体は、放射能を示さない。
非安定同位体。
非安定同位体は放射能を示す。
マジックナンバー
安定同位体。
マジックナンバーは、最も安定な同位体の陽子数または中性子数を示す。
不安定な同位体。
不安定な同位体の陽子数や電子数は、マジックナンバーでは示されない。
アプリケーション
安定同位体。
安定同位体は、放射能が存在してはならない用途に使用されます。
非安定同位体。
DNA分析など、放射能が重要視される用途に使用される。
半減期
安定同位体。
安定同位体の半減期は非常に長いか、全く半減期がない。
非安定同位体。
不安定同位体の半減期は短く、簡単に計算できる。
結論
地球上のすべての元素は、安定同位体と不安定同位体の2つに分類される。
安定同位体とは、天然に存在する放射線を発しない元素のことです。
不安定同位体とは、原子核が不安定な原子のことです。
したがって、これらの元素は放射能を帯びます。
これが安定同位体と不安定同位体の大きな違いです。
放射能は多くの用途で有用ですが、放射線は私たちのDNAに突然変異を起こし、癌細胞の形成につながる可能性があるため、健康にはよくありません。
