上のAddThis共有ボタン
主な違い – 陽電子放出と電子捕獲
天然に存在する同位体の中には、原子核に含まれる陽子と中性子の数が不均衡なため、不安定なものがあります。
そのため、これらの同位体は安定になるために、放射性崩壊と呼ばれる自発的な過程を経ます。
放射性崩壊は、特定の元素の同位体を別の元素の同位体に変化させる。
崩壊の経路には、陽電子放出、陰電子放出、電子捕獲などさまざまなものがあります。
陽電子放出とは、放射性崩壊の過程で陽電子と電子ニュートリノが放出されることです。
電子捕獲は、電子ニュートリノを放出する過程です。
これらの過程はどちらも陽子が豊富な原子核で起こります。
陽電子放出は、放射性原子核内の陽子が中性子に変換され陽電子を放出し、電子捕獲は、中性原子の陽子過剰核が内殻電子を吸収し、陽子を中性子に変換して電子ニュートリノを放出します。
これが陽電子放出と電子捕獲の主な違いです。
陽電子放出とは?
陽電子放出とは、放射性原子核の中の陽子が中性子に変換され、陽電子と電子ニュートリノが放出される放射性崩壊の一種です。
ベータプラス崩壊とも呼ばれる。
陽電子とは、電子と同じ質量を持ち、数値的には等しいが正の電荷を持つ素粒子です。
ベータ粒子(β+またはe+)とも呼ばれる。
電子ニュートリノ(Ve)は、正味の電荷を持たない素粒子です。
陽電子放出は、陽子を多く含む放射性核種において行われる。
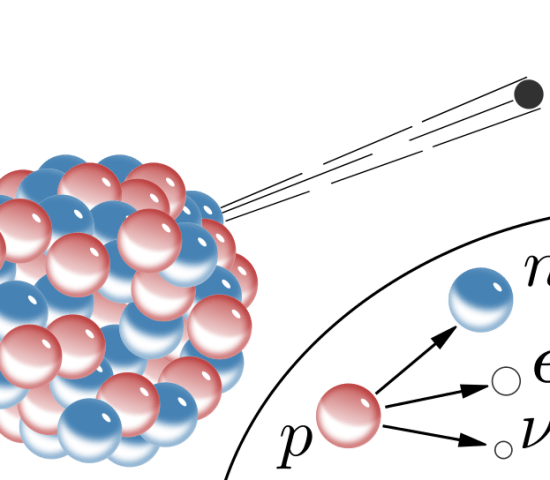 図1:陽電子放出図解
図1:陽電子放出図解
原子の原子番号は原子核に存在する陽子の総数ですが、陽電子放出では原子番号が1つ減ります。
しかし、陽電子放出では、この陽子のうちの1つが変換されます。
そのため、原子番号が小さくなってしまうのです。
しかし、原子の質量数は変わりません。
陽子は中性子に変換され、質量数は原子の中の陽子と中性子の和になるからです。
以下の核反応は、陽電子放出の一例です。
611C → 511B + e+ + Ve + エネルギー
これは炭素の同位体です。
炭素の放射性同位体です。
陽電子放出によりホウ素-11に崩壊する。
ホウ素-11は、ホウ素の安定同位体です。
電子捕獲とは
電子捕獲とは、原子核が内殻電子を吸収して陽子を中性子に変換し、電子ニュートリノとガンマ線を放出する放射性崩壊の一種である。
この過程は陽子数の多い原子核で起こる。
内殻電子とは、原子の内側のエネルギー準位(例:K殻、L殻)にある電子のことです。
同時に、この過程で電子ニュートリノが放出されます。
この過程の核反応は次のように与えられる。
P + e- → n + Ve + γ
図2: 電子捕獲の原理
原子番号とは原子核に含まれる陽子の総数であり、この過程で陽子は中性子に変換されるため、電子捕獲により原子番号が1つ減少する。
ただし、質量数は変化しない。
電子捕獲により電子殻の電子が1個失われますが、陽子1個の損失(正電荷)と釣り合うため、原子は電気的に中性に保たれます。
13N7 + e- → 13C6 + Ve + γ
上記の反応により、窒素同位体の電子捕獲が行われる。
これは電子ニュートリノとガンマ線とともに炭素13原子を形成する。
炭素13は天然で安定な炭素の同位体です。
陽電子放出と電子捕獲の類似性
- どちらも放射性崩壊の一形態です。
- どちらの形式も陽子が豊富な場所で行われる。
- どちらの形式も電子ニュートリノを放出する。
- どちらの形式も、原子の原子番号や質量数を変更しない。
陽電子放出と電子捕獲の違い
定義
陽電子放出。
陽電子放出とは、放射性原子核の中の陽子が中性子に変換され、陽電子と電子ニュートリノが放出される放射性崩壊の一種です。
電子捕獲。
原子核が内殻電子を吸収して陽子を中性子に変換し、電子ニュートリノとガンマ線を放出する放射性壊変の一種。
エミッション
陽電子放出。
陽電子放出:電子ニュートリノと一緒に陽電子を放出する。
電子捕獲。
電子捕獲:電子ニュートリノとガンマ線が放出される。
定義
P
結論
ある元素の不安定な同位体が放射性崩壊すると、その同位体は別の化学元素の別の同位体に変換されます。
いくつかの崩壊経路があります。
陽電子放出と電子捕獲は、そのような経路の2つです。
陽電子放出と電子捕獲の主な違いは、陽電子放出では放射性原子核内の陽子が中性子に変換され陽電子を放出するのに対し、電子捕獲では中性原子の陽子過剰核が内殻電子を吸収し、陽子を中性子に変換して電子ニュートリノを放出することです。
