主な違い – プロチウム vs 重水素 vs トリチウム
プロチウム、重水素、トリチウムは、水素元素の同位体です。
同位体とは、同じ元素でも、原子核に含まれる中性子の数によって、互いに異なる形態をとるものをいいます。
そのため、同位体は原子番号が同じで、原子質量が異なる。
このため、同位体は物理的性質が異なるが、同位体に存在する電子の数が等しいため、化学的性質は変わらない。
したがって、プロチウム、重水素、トリチウムには共通点もあれば相違点もあります。
プロチウム・重水素・トリチウムの主な違いは、プロチウムは原子核に中性子を持たないのに対し、重水素は中性子1個、トリチウムは中性子2個から構成されていることです。
プロティウムとは
プロチウムは水素の同位体で、陽子1個と電子1個で構成されています。
水素の中で最も多く存在する。
地殻中の存在比は約99.9%です。
プロチウムは原子核に中性子を持たない。
水素の中で最も安定な同位体と考えられています。
したがって、通常、水素といえば、プロチウムのことを指します。
プロチウムの原子番号は、陽子が1つあるため1です。
また、プロチウムの原子核には中性子がないため、質量数は1です。
プロチウムの原子質量は約1.00794amuです。
プロチウムの記号は1Hです。
プロチウムの電子配置は、1s1です。
プロチウムは自然界では2原子の気体として、またはH2O分子の水素として存在することができます。
2原子分子の2つの原子間の結合は、より高い結合解離エンタルピーを持つ。
これは、これらの原子が微小であり、2原子分子の形で唯一の軌道(s軌道)に完全な電子配置を持つことが主な理由です。
上の図は、プロチウムの原子構造を示しています。
ここでは、原子の中心(原子核)に陽子を、原子核の外側に電子を青色で表している。
重水素とは
重水素は水素の同位体で、陽子1個、中性子1個、電子1個で構成されています。
重水素の原子核は陽子1個と中性子1個で構成されています。
重水素の記号は2Hと与えられています。
重水素の原子番号は1、質量数は2であり、原子質量は2.014amuと与えられます。
これも水素の安定同位体ですが、存在量は少なくなっています。
地殻中の重水素の存在量は0.015%と計算されています。
重水素は原子核に陽子1個と中性子1個を持つ安定同位体なので、放射性物質ではない。
図2: 重水素の原子構造
重水素は、気相と液相の2つの状態で存在します。
重水素は、D2やHD(水素との組み合わせ)のような2原子ガスとして存在します。
そうでない場合は、重水として存在することがあります。
重水はD2O分子で構成されています。
ほとんどの場合、重水素はプロチウムと同じように作用します。
しかし、ある種の違いもあります。
中性子の存在により、重水素の原子質量はプロチウムの2倍となります。
そのため、結合の長さや結合エネルギーがプロチウムとは異なります。
また、重水から作られた氷は密度が高いため、液体水中に沈んでしまいます(通常の氷は液体水面に浮く)。
重水素の応用もあります。
NMR分光法では、水素で構成される化合物の代わりに重水素を含む化合物を溶媒として使用します。
この場合、分析対象物の水素原子が示すピークを、溶媒の原子で区別することができる。
トリチウムとは
トリチウムは水素の同位体で、陽子1個、中性子2個、電子1個で構成されています。
トリチウムの記号は 3H です。
トリチウムの原子番号は1、原子質量は3で、質量は3.016amuと与えられます。
この水素の同位体は、陽子の数に比べて多くの中性子が存在するため、放射性物質です。
トリチウムはしばしばベータ崩壊を起こします。
これによってヘリム3が生成され、大量のエネルギーを放出します。
トリチウムの半減期は12.32年と計算されています。
しかし、地殻に存在するトリチウムの量は非常に少ない。
上の図は、トリチウムの原子構造を示しています。
トリチウムは2個の中性子(赤色)と1個の陽子(青色)を持つため、質量数は3です。
プロチウム・重水素・トリチウムの類似性
- プロチウム、重水素、トリチウムは水素の同位体です。
- これらの同位体は、1つの原子核につき1個の陽子で構成されています。
- 3つとも1個の電子で構成されています。
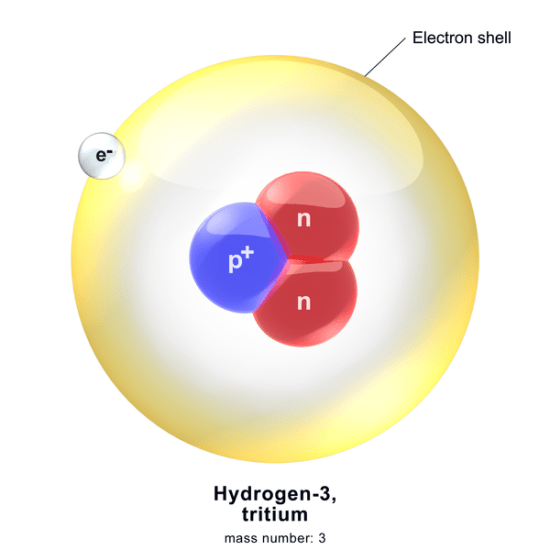 図4: プロチウム・重水素・トリチウム
図4: プロチウム・重水素・トリチウム
プロチウム・重水素・トリチウムの違い
定義
プロチウム。
プロチウムは水素の同位体で、陽子1個と電子1個で構成されている。
重水素 水素の同位体で、陽子1個、中性子1個、電子1個からなる。
トリチウム。
水素の同位体で、陽子1個、中性子2個、電子1個から構成される。
豊かさ
プロチウム プロチウムの存在比は約99.9%です。
重水素。
重水素の存在比は約0.015%です。
トリチウム。
トリチウムはごく微量に存在する。
化学記号
プロチウム プロチウムの記号は1Hです。
重水素。
重水素の記号は1Hです。
トリチウム トリチウムの記号は1Hです。
質量数
プロチウム プロチウムの質量数は1です。
重水素。
重水素の質量数は2です。
トリチウム トリチウムの質量数は3。
原子質量
プロチウム プロチウムの原子質量は1.00794amuです。
重水素。
重水素の原子質量は2.014amuです。
トリチウム。
トリチウムの原子質量は3.016amuです。
放射能
プロチウム プロチウムは放射性物質ではない。
重水素。
重水素は放射性物質ではない。
トリチウム。
トリチウムは放射性物質です。
結論
プロチウム、重水素、トリチウムは、水素の3つの同位体です。
これらの同位体以外にも、いくつかの水素の形が存在する可能性があります。
しかし、これらは中性子を多く含むため、非常に不安定です。
プロチウムとトリチウムの主な違いは、プロチウムは原子核に中性子を持たず、重水素は中性子1個、トリチウムは中性子2個から構成されていることです。
