主な相違点 – 相対原子質量と原子質量
原子は物質の基本単位です。
科学的な発見により、原子はさらに電子、陽子、中性子という素粒子に分けられることが明らかになりました。
また、原子は原子核と呼ばれる中心核と、この原子核の周りを動く電子からなる複雑な構造を持っていることが発見された。
原子核の中には、陽子と中性子が含まれている。
原子の質量を表す化学用語として、相対原子質量と原子質量があります。
相対原子質量と原子質量の大きな違いは、相対原子質量が元素の原子の平均質量と炭素12の質量の12分の1との比であるのに対し、原子質量は原子の原子核に存在する核子の総質量であることである。
相対原子質量とは
相対原子質量とは、ある元素の原子の平均質量と炭素12原子の質量の12分の1との比をいいます。
炭素12原子の質量の12分の1を原子質量単位(1amuまたは1u)と呼びます。
したがって、炭素12の相対原子質量は12amuです。
相対原子質量=原子の平均質量/炭素12の質量×(1/12)
原子の平均質量は、元素の異なる同位体の質量とその存在量から計算されます。
炭素12の同位体の質量の12分の1の値は、1.66054×10-18gです。
これは1u、すなわち1統一原子質量単位に相当します。
水素原子を考えて、相対原子質量を計算してみましょう。
水素の相対的な原子質量
まず、水素原子の平均的な質量を求める必要があります。
| 同位体|存在比(%)|質量(u)|など。 | ||
| 水素-1|99.98|1.007825||です。 | ||
| 水素-2|0.02|2.014101||||。 | ||
| 水素3|微量|3.016049 |
水素の平均質量 = (1.007825 u x 99.98%) + (2.014101 u x 0.02 %)
= (1.007623 + 0.0000402) u
= 1.0076632 u
炭素12同位体の質量の12分の1の値は1uです。
したがって
相対原子質量=原子の平均質量/炭素12の質量×(1/12)
= 1.0076632 u / 1 u
= 1.0076632
ここで、トリチウムの質量は、環境中の存在量が微量で無視できるため、計算には含めなかった。
最終的な値は相対的な値であるため無次元です。
原子質量とは
原子質量は、原子の原子核に存在する核子の総質量です。
核子とは、陽子または中性子のことです。
したがって、原子質量は、原子核に存在する陽子と中性子の質量の合計となります。
原子には電子も存在しますが、電子は陽子や中性子と比べると非常に小さく、無視できる質量なので、電子の質量は計算には使いません。
相対原子質量とは異なり、ここでは平均値を計算することなく、一つ一つの原子の質量を計算します。
そのため、同位体によって原子質量が異なる値が得られます。
それは、同じ元素の同位体でも、存在する核子の数が互いに異なるからです。
相対原子量と同じ例で、水素について考えてみましょう。
水素2の原子量
水素2(重水素)の同位体の原子質量は、次のように計算されます。
原子核に含まれる陽子の数=1
原子核の中の中性子の数=1
水素の原子質量 = (1 amu +1 amu)
= 2 amu
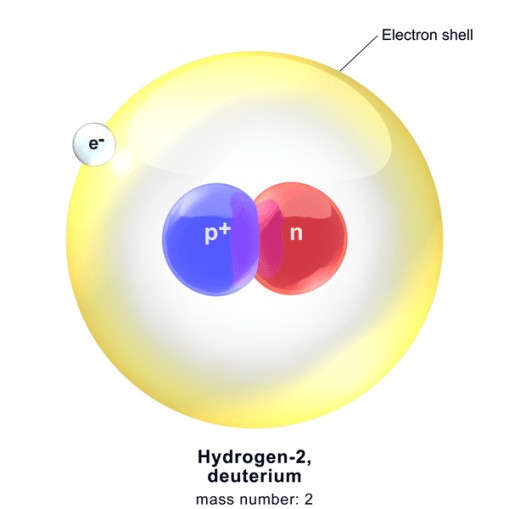 図2:重水素の構造
図2:重水素の構造
原子質量は、amu(原子質量単位)という単位で与えられます。
陽子1個または中性子1個の質量は1amuです。
相対原子質量と原子質量の違い
定義
相対原子質量。
相対原子質量は、ある元素の原子の平均質量と炭素12の質量の12分の1との比です。
原子質量。
原子質量:原子の核に存在する核子の総質量。
同位体
相対原子質量。
相対原子質量は、ある元素の全同位体の質量と存在比から計算される。
原子質量。
原子質量は、核子の質量を加算して、各同位体について個別に計算される。
値
Relative Atomic Mass(相対原子質量)。
相対原子質量は、炭素12原子の質量の12分の1に対する値です。
Atomic Mass:原子質量。
原子質量の値は、直接計算された値である(相対値ではない)。
単位
相対的原子質量。
相対的な値であるため、無次元です。
原子質量。
原子質量は単位amuで与えられる。
結論
原子質量と相対原子質量は、化学用語として重要な2つの用語です。
この2つの用語は似ているように聞こえますが、その概念は異なっています。
相対原子質量と原子質量の主な違いは、相対原子質量が元素の原子の平均質量と炭素12の質量の12分の1との比であるのに対し、原子質量は原子の原子核に存在する核子の全質量であることです。
