主な違い – 原子軌道と分子軌道の違い
軌道とは、電子が見つかる確率が高い領域と定義されています。
原子は原子核の周りを電子が回転しています。
この軌道が結合によって重なり合って分子を形成するとき、その軌道を分子軌道と呼ぶ。
原子軌道の性質を説明するのが価電子結合論、分子軌道の性質を説明するのが分子軌道論です。
軌道は最大2個の電子を保持することができる。
原子軌道と分子軌道の主な違いは、原子軌道の電子は1個の正の原子核の影響を受けるのに対し、分子軌道の電子は分子内の原子の数に応じて2個以上の原子核の影響を受けることです。
この記事で解説しています。
- 原子軌道とは
– 定義、特徴、性質 - 分子軌道とは
– 定義、特徴、性質 - 原子軌道と分子軌道の違いとは
原子軌道とは?
原子軌道とは、電子が最も高い確率で存在する領域のことです。
量子力学は、原子の電子の位置の確率を説明するものです。
ある時間における電子の正確なエネルギーは説明できない。
ハイゼンベルクの不確定性原理で説明されている。
原子の電子密度は、シュレディンガー方程式の解から求めることができる。
原子の軌道は最大2個の電子を持つことができる。
原子の軌道は、s、p、d、fのサブレベルとしてラベル付けされている。
これらの軌道は異なる形状をしている。
s軌道は球状で、最大2個の電子を保持する。
サブエネルギー準位は1つです。
p軌道はダンベル型で、最大6個の電子を保持することができます。
3つのサブエネルギー準位を持つ。
dおよびf軌道は、より複雑な形状をしている。
d準位は5つのサブエネルギー準位を持ち、最大10個の電子を保持することができ、f準位は7つのサブエネルギー準位を持ち、最大10個と15個の電子を保持することができる。
軌道のエネルギーは、s<p<d<fの順となる。
分子軌道とは?
分子軌道の性質は、分子軌道理論によって説明される。
1932年にF.HundとR.S.Mullikenによって初めて提唱された。
分子軌道理論によると、原子が融合して分子を形成するとき、重なり合っていた原子軌道は原子核の影響で形を失い、分子軌道が新たに存在する。
このとき、分子内に新たに存在する軌道を分子軌道と呼ぶようになった。
分子軌道は、ほぼ同じエネルギーの原子軌道が組み合わさって形成されている。
原子軌道とは異なり、分子軌道は分子内の1つの原子に属するのではなく、分子を構成するすべての原子の原子核に属します。
そのため、異なる原子の原子核は多心核として振る舞う。
分子軌道の最終的な形状は、分子を構成する原子軌道の形状に依存する。
アウフバウ則によれば、分子軌道は低エネルギー軌道から高エネルギー軌道へと充填される。
原子軌道と同様に、分子軌道も最大2個の電子を保持することができる。
ただし、パウリの原理により、この2つの電子は反対のスピンを持っていなければならない。
分子軌道における電子の振る舞いは、シュレディンガー方程式で記述することができる。
しかし、分子は複雑であるため、シュレディンガー方程式を適用することは非常に難しい。
そこで科学者たちは、分子内の電子の振る舞いを近似的に評価する方法を開発した。
この方法は、原子軌道の線形結合法(LCAO法)と呼ばれる。
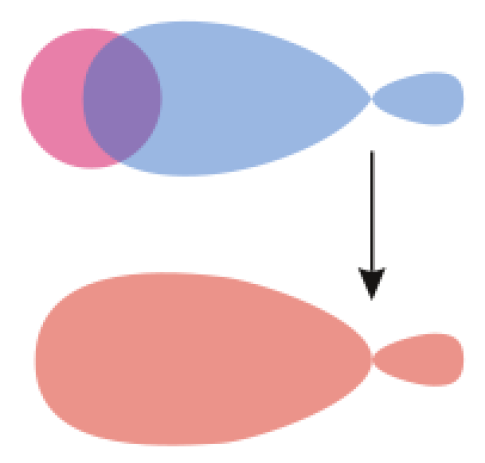 :図2 分子軌道の形成
:図2 分子軌道の形成
原子軌道と分子軌道の違い
定義
原子軌道。
原子の中で最も電子の存在する確率の高い領域。
分子軌道。
分子軌道は、分子の電子が見つかる確率が最も高い領域。
フォーメーション
原子軌道。
原子軌道は、原子の周りの電子雲によって形成される。
分子軌道。
分子軌道は、ほぼ同じエネルギーを持つ原子軌道が融合して形成される。
形状
原子軌道。
原子軌道の形状は、原子軌道の種類(s、p、d、f)により決定される。
分子軌道。
分子軌道の形状は、分子を構成する原子軌道の形状によって決定される。
電子密度を記述する
原子軌道 シュレディンガー方程式を用いる。
分子軌道。
原子軌道の線形結合(LCAO)を用いる。
核
原子軌道。
原子軌道は、1つの原子核の周りにあるため、単心です。
分子軌道。
分子軌道は、異なる原子核の周囲に存在するため、多心的です。
核の効果
原子軌道。
分子軌道。
分子軌道:さらに2個の原子核が分子軌道の電子雲に影響を与える。
概要
原子軌道と分子軌道は、それぞれ原子と分子で最も電子密度が高い領域です。
原子軌道の性質は原子の原子核1個によって決まるが、分子軌道の性質は分子を形成する原子軌道の組み合わせによって決まる。
これが、原子軌道と分子軌道の大きな違いです。
