主な違い – メタンとエタンの違い
メタンとエタンは単純な有機分子です。
これらはアルカン化合物です。
メタンもエタンも常温では無色無臭の気体化合物です。
メタンは主要な温室効果ガスです。
エタンも温室効果ガスであるが、大気中に存在する量は少ない。
メタンとエタンには、化学的・物理的な性質に多くの違いがあります。
メタンとエタンの主な違いは、メタンが炭素原子1個と水素原子4個が結合しているのに対し、エタンは炭素原子2個が互いに結合し、各炭素原子が水素原子3個と結合していることである。
メタンとは
メタンは化学式CH4で表される無色・無臭の気体です。
炭素原子1個と水素原子4個が結合した最も小さなアルカンです。
メタンのモル質量は約16g/molです。
メタンの沸点は約161℃です。
そのため、メタンの蒸気は通常の空気よりも軽い。
図1: メタンの分子構造
分子の形状は四面体です。
このガスは可燃性ガスです。
発火しやすく、熱や炎を発生させる。
メタンの主な供給源は天然ガスです。
天然ガスの約70%がメタンです。
天然ガスには、メタン以外にエタン、プロパン、その他の炭化水素が微量に含まれています。
しかし、メタンは、嫌気性菌による植物体の分解を経て、バイオガスとして生成されることもあります。
メタンは容易に燃焼する。
これは非常に発熱性の高い反応です。
メタンの燃焼によって得られる最終生成物は、二酸化炭素と水蒸気です。
メタンの不完全燃焼は、炭素の煤(カーボンダスト)を形成する。
メタンは、メタノールやクロロホルムなど、重要な化学物質の製造に使用される。
メタンは太陽熱を吸収して大気を暖めるので、温室効果ガスとみなされる。
これは、赤外線を吸収し、その熱を地表に放射することによって行われます。
その結果、気候が変化するのです。
エタンとは
エタンは化学式C2H6で表される無色・無臭の気体です。
エタンのモル質量は約30g/mol。
炭化水素化合物の一種で、アルカンの一種である。
エタン分子は、2つの炭素原子が1つの共有結合を介して互いに結合したものです。
各炭素原子は3つの水素原子と結合している。
エタンの形状は1つの炭素原子を考慮して与えられており、1つの炭素原子で正四面体となっています。
C-Cシグマ結合があるため、他のシグマ結合はこのC-C結合の周りを自由に回転することができる。
そのため、エタンにはコンフォメーション異性体が存在する。
エタンには、食用と千鳥のコンフォメーションがあります。
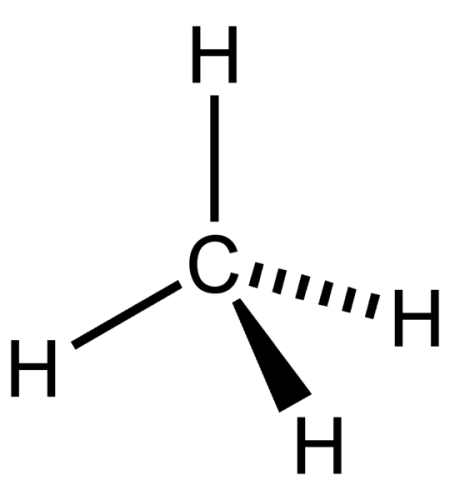 図2: エタンの異性体。
図2: エタンの異性体。
エタンの燃焼は発熱が大きく、多量の熱を発生する。
エタンを完全燃焼させると、二酸化炭素と水蒸気が最終生成物として発生する。
エタンの不完全燃焼では、二酸化炭素と水蒸気とともに一酸化炭素が生成される。
また、炭素の煤(カーボンブラック)が発生することもあります。
エタンは天然ガス中に含まれる。
天然ガスの約15%がエタンです。
エタンの沸点は約-88.5℃です。
したがって、エタンは常温で気体の化合物です。
エタンも温室効果ガスです。
しかし、大気中にはあまり存在しないため、エタンが温室効果に与える影響はそれほど大きくはない。
メタンとエタンの類似性
- どちらも炭化水素化合物です。どちらも炭化水素化合物であり、アルカンです。
- 常温で気体の化合物です。
- どちらも可燃性ガスです。
- どちらも飽和化合物(二重結合や三重結合が存在しない)です。
メタンとエタンの違い
定義
メタン:化学式CH4で表される無色・無臭の気体。
エタン:化学式C2H6で表される無色・無臭の気体。
炭素原子の数
メタン:1分子中に炭素原子が1つだけある。
エタン:1分子中に炭素原子が2個ある。
C-C結合
メタン:メタンにはC-C結合はない。
エタン:エタンにはC-C結合が1つある。
コンフォメーション異性体
メタン:メタンのコンフォメーション異性体は存在しない。
エタン:エタンには立体配座異性体として偏肉異性体、千鳥異性体があります。
沸点
メタン:沸点は約-161ºC。
エタン:沸点は約-88.5℃。
発生状況
メタン:天然ガスの主成分はメタンであり、約70%を占める。
エタン:天然ガスには約15%のエタンが含まれる。
温室効果
メタン:メタンは温室効果への寄与が大きい。
エタン:エタン蒸気は大気中にあまり存在しないので、温室効果への寄与は少ない。
結論
メタンとエタンは、いずれも天然ガスに含まれる炭化水素化合物です。
これらは可燃性ガスです。
メタンとエタンの主な違いは、メタンが炭素原子1個と水素原子4個が結合しているのに対し、エタンは炭素原子2個が互いに結合し、各炭素原子が水素原子3個と結合していることである。
