主な違い – 陽子 vs 中性子 vs 電子
陽子、中性子、電子は、一般に素粒子と呼ばれています。
原子を構成するのに不可欠な要素です。
原子はそれぞれ異なる数の陽子、中性子、電子を持っています。
そして、それが原子のアイデンティティと独自性を保つ方法なのです。
電荷も違えば、質量も違う。
また、それぞれの素粒子の役割も、互いにかなり異なっている。
陽子、中性子、電子の主な違いは、その電荷にあります。
陽子は正電荷、中性子は中性であるのに対し、電子は負電荷を帯びています。
陽子とは
陽子は原子の原子核にあり、中性子と一緒に存在しています。
陽子はラザフォードによって発見された。
ラザフォードは、原子の空間の大部分は空であり、質量は原子核と呼ばれる原子の中の小さな密な領域にのみ集中していると主張していた。
陽子は正の電荷を帯びている。
この場合の電荷は、電子のクーロン電荷の量で定義される。
陽子の電荷は電子の電荷と等しいので、1eと表すことができる。
(1e=1.602 *10-19 C)となる。
原子核は陽子の存在により、正の電荷を帯びたままです。
陽子は重く、その質量は1.672 ㎤* 10-27 kgです。
前述したように、陽子は原子の質量に容易に寄与している。
陽子は中性子と合わせて「核子」と呼ばれる。
どの原子にも1つ以上の陽子が存在する。
陽子の数は原子ごとに異なり、原子のアイデンティティを形成している。
周期表で元素をグループ分けする場合、陽子の数をその元素の原子番号として使用する。
The proton is symbolized as ‘p.’ Protons do not take part in chemical reactions, and they only get exposed to nuclear reactions. 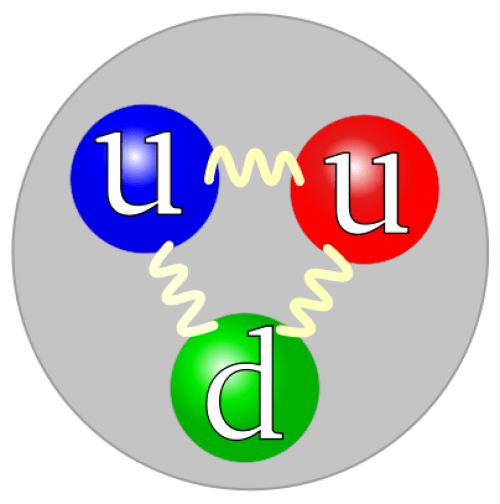
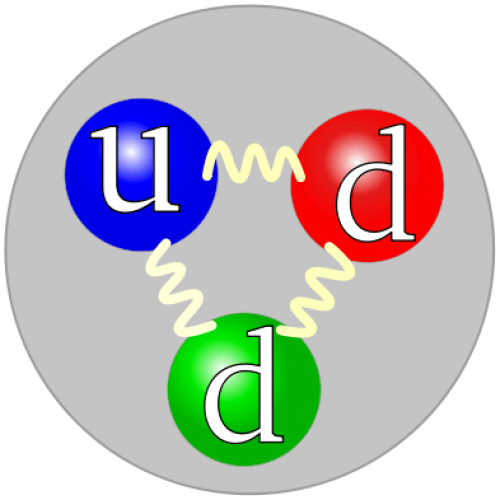
中性子とは何か
前述のように、中性子は原子核の中で陽子と一緒に存在しています。
しかし、中性子は荷電粒子ではありません。
したがって、反発する力を持たずに陽子と快適に空間を共有することができます。
例えば、中性子がマイナスに帯電していれば陽子と引き合うし、プラスに帯電していれば反発することになります。
中性子の重さは陽子より少し重い。
しかし、おおよそ1原子質量単位の質量であると考えられている。
中性子の数は、陽子の数とともに、原子質量数を形成する。
原子核の中の中性子と陽子の数は似て非なるものです。
中性子は「n」で記号化できる。
また、中性子は化学反応に参加せず、核反応にのみさらされる。
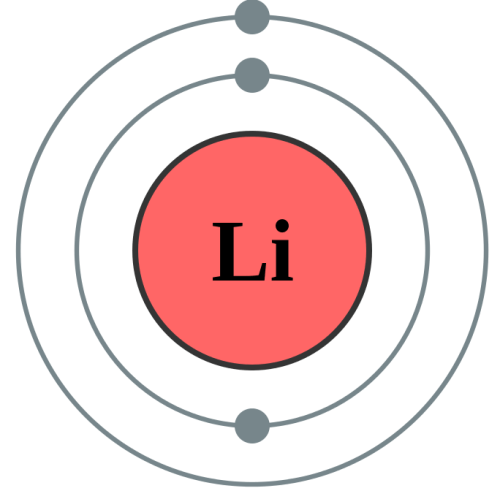
電子とは
電子は3種類目の素粒子で、原子核の周りをエネルギーレベルの異なる殻で周回しています。
電子は負の電荷を帯びており、各電子は1eに等しい電荷を帯びている。
電子の重さは、陽子や中性子の重さに比べれば、たいしたことはないと考えられているほど小さい。
陽子の数と同じように、原子の中の電子の数は、各元素のアイデンティティを担っている。
各元素の中で電子がどのように殻に分布しているかは、電子配置で表されます。
電子の数は、元素に含まれる陽子の数と似ている。
電子は「e」と記号化される。
電子は、化学反応に参加する唯一の素粒子です。
また、ある種の核反応にも関与している。
陽子、中性子、電子の違い
定義
陽子は、原子の中にある正電荷の素粒子です。
中性子は、原子の中にある中性の素粒子です。
電子は、原子の中にある負の電荷を帯びた素粒子です。
原子内に存在する
陽子は原子核の中にあり、核子のグループに属しています。
中性子は原子核の中にあり、核子のグループに属しています。
電子は、原子核の周りを定められたエネルギーレベルで回っている。
チャージ
陽子は正の電荷を帯びている。
中性子は中性。
電子は負の電荷を帯びている。
重量
陽子の重さは 1.672 ㎟ 10-27kg です。
中性子の重さは陽子より少し重い。
電子の重さは、陽子と中性子の重さに比べてごくわずかです。
記号
陽子は’p’と記号化される。
中性子は’n’と記号化される。
電子は’e’と記号化される。
反応
陽子は核反応にしか参加しない。
中性子は核反応にのみ参加する。
Electrons take part in both chemical and nuclear reactions.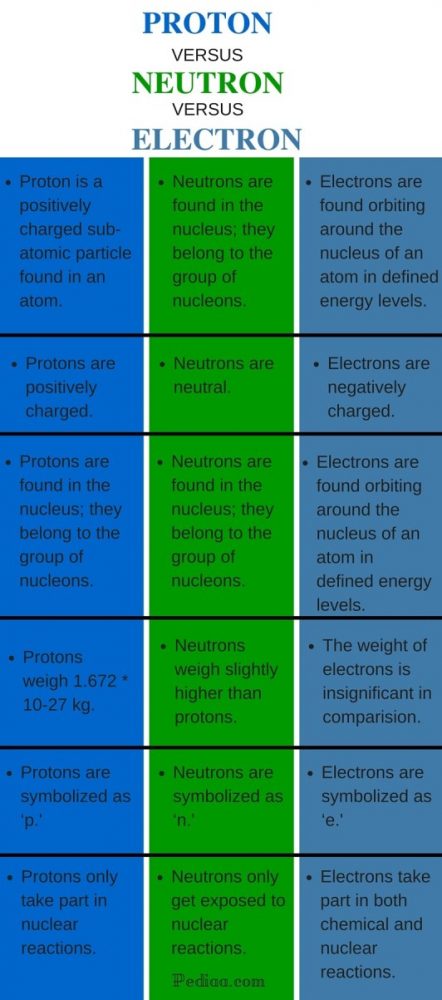
「クオーク構造陽子」 by Arpad Horvath – 自作。
“クォーク構造中性子” by No machine-readable author provided. ハープを想定(著作権の主張から)。
“Electron shell 003 Lithium – no label” by Pumbaa (原作: Greg Robson) – File:Electron shell 003 Lithium.svg. (CC BY-SA 2.0 uk) via Commons
保存する
