主な違い – 原子価と価
原子価と価は、原子と分子に関してよく使われる2つの化学用語です。
原子量とは、分子内に存在する原子の数のことです。
原子価は、原子が安定化するために失うか、得るか、共有しなければならない電子の最大数です。
したがって、これらは原子と分子の2つの異なる特性です。
原子価と価の主な違いは、原子価が分子の性質を説明するのに対し、価は元素の性質を説明することです。
アトミシティとは
原子性とは、分子内に存在する原子の総数のことである。
この定義によれば、分子は原子性の違いによってグループに分けることができる。
例えば、分子は単原子、二原子、三原子、多原子となることができる。
単原子化合物は、単一の原子で構成されている。
例えば、ヘリウム(He)、アルゴン(Ar)などの不活性ガスは、単原子化合物です。
2原子化合物は、1分子につき2つの原子で構成されている。
例:酸素ガス(O2)、窒素ガス(N2)、塩素ガス(Cl2)等。
原子性を表す記号は “a “です。
したがって、単原子化合物の場合はa=1、2原子化合物の場合はa=2となる。
多原子化合物の場合、原子度は大きな値になる。
これは、多原子分子の場合、多数の原子から構成されているためです。
同じグループ(周期表)の元素が作る化合物の原子性を考えると、その化合物の化学的・物理的性質の関係を観察することができる。
例えば、不活性ガスはすべて単原子化合物であり、化学的性質が似ている。
また、化学的・物理的性質が互いに大きく異なる化合物でも、その原子性の違いによって同じ化合物群に属する場合があります。
例えば、Cl2は気体であるのに対し、I2は室温で固体です。
しかし、これらの化合物は、その原子価を考慮すると、どちらも2原子化合物です。
Valencyとは
原子価とは、原子が安定するために失う、得る、または共有することができる電子の最大数として定義することができる。
金属や非金属の場合、八分則は原子の最も安定な形を記述する。
これは、原子の最外殻の数が8個の電子で完全に満たされていれば、その配置は安定であると言うものです。
つまり、sとpの副軌道が完全に埋まり、ns2np6を持てば安定なのです。
当然ながら、希ガス原子はこの電子配置をしている。
したがって、他の元素は八重項則に従うために、電子を失うか、獲得するか、共有する必要がある。
この安定化過程に関与する電子の最大数をその原子の価数と呼ぶ。
硫黄を例にとって考えてみましょう。
硫黄の価数は次のように求めることができます。
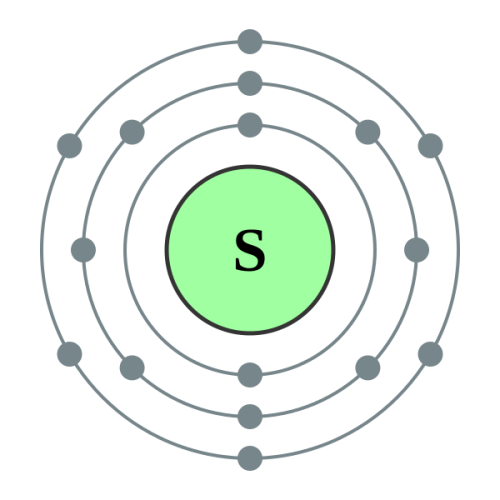 図2:硫黄原子の化学構造
図2:硫黄原子の化学構造
硫黄の最外周軌道の電子数は6個ですが、安定化させるためには最外周軌道の電子数を8個にする必要があります(オクテット則による)。
そこで、硫黄はさらに2個の電子を外から獲得するか共有しなければならない。
したがって、硫黄の原子価は2です。
しかし、遷移元素は異なる価数を持つことがあります。
これは、遷移金属は異なる数の電子を取り除くことで安定化させることができるからです。
原子性と原子価の違い
定義
原子量。
原子数:分子内に存在する原子の総数。
原子価。
原子価は、原子が安定化するために失う、得る、または共有できる電子の最大数です。
決定事項
原子量。
原子量は、物質1分子あたりに存在する原子の数を計算することによって決定することができる。
価数。
原子価は、原子の電子配置を見ることによって決定することができる。
原子数
原子数。
原子数:分子内に存在する原子の数。
価数。
原子価は、原子の数に依存しない。
電子との関係
原子性。
原子性は、原子の電子数とは関係ない。
価数。
原子価は電子の数に直接関係する。
異なるタイプ
原子数。
原子数によって、単原子、二原子、三原子、多原子化合物に分けられる。
価数。
元素はその価数によって、1価、2価などの名前があります。
結論
原子数とは、分子内に存在する原子の数です。
原子価は、原子が安定化するために失うか、得るか、共有しなければならない電子の最大数です。
原子価と価の主な違いは、原子価が分子の性質を説明するのに対し、価は元素の性質を説明することである。
