主な違い – アセトアルデヒドとアセトン
アセトアルデヒドとアセトンは、炭素原子と酸素原子1個、および水素原子数個からなる有機化合物です。
しかし、官能基が異なるため、化学的・物理的性質が異なります。
官能基とは原子の一部であり、分子の特性を決定する原子の集まりです。
アセトアルデヒドもアセトンも室温・常圧では液体の化合物です。
アセトアルデヒドとアセトンの主な違いは、アセトアルデヒドがアルデヒドであるのに対し、アセトンはケトンであることです。
アセトアルデヒドとは
アセトアルデヒドは、化学式C2H4Oで表される有機化合物です。
常温常圧では無色の液体で存在する。
アルデヒド基(-CHO)からなるアルデヒドです。
アセトアルデヒドのモル質量は44.05g/molです。
図1:アセトアルデヒドの化学構造
アルデヒド基にメチル基が結合した単純なアルデヒド分子です。
アセトアルデヒドの融点は-123.37℃、沸点は20.2℃です。
アセトアルデヒドの系統的なIUPAC名はエタナールです。
アセトアルデヒドは、1-ブタノール、酢酸エチルなど一部の化合物の製造に使用されます。
また、香水、合成ゴム、調味料などの製造にも使用されます。
純粋なアセトアルデヒドは、無色で可燃性の液体です。
アセトアルデヒドの主な製造工程は、ワッカー法と呼ばれます。
エチレンのアセトアルデヒドへの酸化の触媒作用が含まれます。
触媒は、塩化パラジウムと塩化銅の2成分の混合物です。
アセトアルデヒドは、縮合反応や互変異性化など、重要な化学反応を起こす。
しかし、人間に対しては発がん性のある化合物として認識されている。
長期間さらされると毒性があります。
皮膚や目に刺激性があります。
アセトンとは
アセトンは、化学式C3H6Oで表される有機化合物です。
この化合物のモル質量は58.08g/molです。
ケトンの一種である。
室温、常圧では無色で揮発性の可燃性液体です。
ケトン化合物の中で最も単純なケトンです。
刺激臭があります。
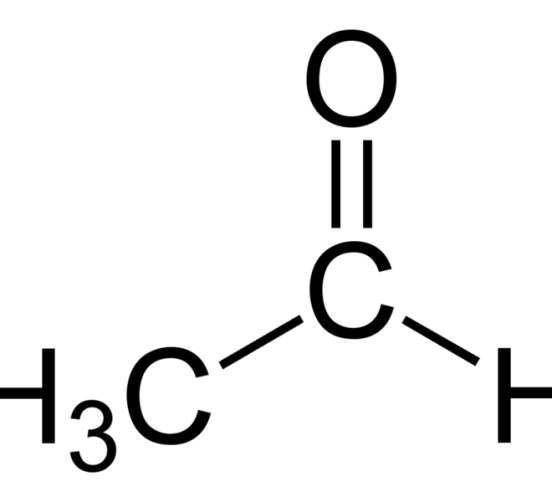 図2:アセトンの化学構造
図2:アセトンの化学構造
アセトンのIUPAC名はPropan-2-oneです。
融点は-94.7℃、沸点は56.05℃です。
水と混和性があります。
アセトンはプロピレンから直接または間接的に製造することができる。
現代的な方法はクメン法です。
ベンゼンをプロピレンでアルキル化し、クメンという化合物をつくる。
次にこのクメンを空気で酸化させる。
すると、フェノールとアセトンができる。
したがって、フェノールと一緒にアセトンも生成される。
アセトンは主に溶剤として使用され、防腐剤としても使用されます。
植物、自動車の排気ガス、動物の脂肪代謝の産物として検出されることがあります。
アセトンは水より密度が小さく、アセトンの蒸気は通常の空気より重い。
アセトアルデヒドとアセトンの違い
定義
アセトアルデヒド:化学式C2H4Oで表される有機化合物です。
アセトン 化学式C3H6Oを有する有機化合物です。
カテゴリー
アセトアルデヒド:アルデヒドの一種。
アセトン アセトンはケトンの一種。
化学式
アセトアルデヒド:化学式は C2H4O です。
アセトン。
アセトンの化学式は、C3H6O。
モル質量
アセトアルデヒド:モル質量は44.05g/molです。
アセトン アセトンのモル質量は58.08g/molです。
融点・沸点
アセトアルデヒド:融点は-123.37℃、沸点は20.2℃です。
アセトン アセトンの融点は-94.7 ℃、沸点は56.05 ℃です。
IUPAC名
アセトアルデヒド:IUPAC名はethanal。
アセトン アセトアルデヒドのIUPAC名はPropan-2-oneです。
結論
アセトアルデヒドとアセトンは有機化合物です。
アセトアルデヒドもアセトンも無色の液体化合物です。
アセトアルデヒドとアセトンの主な違いは、アセトアルデヒドがアルデヒドであるのに対し、アセトンはケトンであることです。
