主な相違点 – モル質量と分子量
分子は、同一または異なる原子が異なる比率で組み合わさってできた物質です。
これらの分子は、互いにくっついて化合物を形成することができます。
ほとんどすべての化学反応は、分子や化合物に変化が起こることが関与しています。
したがって、化学反応を行い、最終的な生成物を予測するためには、分子の化学的および物理的特性を理解することが非常に重要です。
このような物質の物理的性質として、モル質量と分子量があります。
モル質量と分子量の主な違いは、モル質量が特定の物質の1モルの質量を与えるのに対し、分子量は特定の物質の1分子の質量を与えることである。
モル質量とは
Molar mass is the mass of a mole of a particular substance. It is a physical property of substances. The molar mass is obtained by dividing the mass of a particular substance by the amount of it.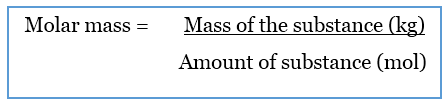
モル質量のSI単位はkgmol-1またはkg/molです。
しかし、一般にはgmol-1またはg/molの単位で与えられます。
元素のモル質量は、その元素の原子質量です。
したがって、ある物質のモル質量は、その分子に存在する各元素の原子質量を足すことによって計算できる。
モル質量の計算
H2O化合物のモル質量を計算してみましょう。
H2Oです。
- 存在する水素原子の数 = 2
- 水素の原子質量 = 1.00794 g/mol
- 存在する酸素原子の数 = 1
- 酸素の原子質量 = 15.999 g/mol
- したがって、H2O のモル質量 = (2 x 1.00794 g/mol) + (1 x 15.999 g/mol)
= 18.01488 g/mol
この単純計算により、H2O化合物1モルの質量は18gであることがわかる。
分子量とは
分子量とは、分子の質量と定義することができます。
また、相対分子量とも呼ばれます。
これは、分子量が炭素12同位体に対する質量として計算されるからです。
Considering a hypothetical molecule called A,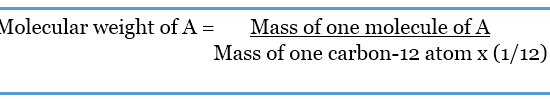
上の式から、分子量には単位がないことがわかる。
これは、同じ単位を持つ2つの質量の間で分割するためです。
従って、分子量は原子質量単位(amu)で示される。
この式から、元素や化合物の分子量を求めることができる。
したがって、モル質量と同じように、ある分子の分子量は各元素の原子質量の和に等しい。
分子量の計算
同じ例としてH2Oを考えてみます。
- 存在する水素原子の数 = 2
- 存在する酸素原子の数 = 1
- 水素原子の質量 = 1.00794 amu
- 酸素原子の質量=15.999amu
- したがって、H2Oの分子量 = (2 x 1.00794 amu) + (1 x 15.999 amu)
= 18.01488 amu
となり、モル質量と分子量は同じ値であるが、単位が異なることがわかる。
分子量は33.99758amuです。
モル質量と分子量の違い
定義
モル質量。
モル質量とは、特定の物質の1モルの質量のこと。
分子量。
分子量とは、分子の質量を意味する。
単位
モル質量。
モル質量の単位はkgmol-1(またはkg/mol)。
分子量。
分子量は無単位だが、amu(原子質量単位)で表示される。
計算方法
モル質量のこと。
モル質量は、物質の質量をその物質の量で割って算出する。
分子量。
分子量は、炭素12原子の質量の12分の1に対する物質の質量として計算されます。
結論
モル質量と分子量の主な違いは、モル質量が特定の物質の1モルの質量を示すのに対して、分子量は特定の物質の1分子の質量を示すことである。
モル質量と分子量では定義や単位が異なるが、値は同じです。
これらは物質の物理的性質であり、化学分析技術において非常に有用です。
