主な相違点 – 加水分解と水和反応
加水分解は、化合物中の水分子を分解し、化学結合を切断することによって、化合物に水分子を付加する反応です。
したがって、加水分解は二重分解反応とみなされます。
水和という用語は、有機化学と無機化学の2つの異なる用途があります。
有機化学では、アルケンやアルキンに水分子が付加することである。
しかし、無機化学では、水和は水分子を開裂させずに結合させること、または結合させることである。
したがって、加水分解と水和の大きな違いは、加水分解が水分子の分割を含むのに対し、水和は水分子の分割を必ずしも含まないことである。
加水分解とは
加水分解は、水を反応物の1つとする二重分解反応です。
言い換えれば、水分子を用いて分子の結合を切断することである。
加水分解反応は多くの場合、可逆的です。
加水分解反応には大きく分けて3つのタイプがあります。
- 酸による加水分解
- 塩基の加水分解
- 塩の加水分解
水は、ブレンステッド-ローリー酸理論(酸と塩基が反応すると、プロトンの交換により、酸はその共役塩基を、塩基はその共役酸を形成する理論)により、酸または塩基として作用することができます。
水がブレンステッド-ロウリー酸として作用する場合、水分子はプロトンを供与する。
ブレンステッド-ローリー塩基として作用する場合、水分子はプロトンを受け入れ、ヒドロニウムイオン(H3O+)を形成することができる。
酸の加水分解は酸の解離反応に似ている。
図1:無水コハク酸の加水分解
塩基の加水分解は、塩基の解離反応に類似している。
このとき、水はプロトンを供与し、水酸化物アニオン(OH-)を生成する。
したがって、水はブレンステッド-ロウリー酸として働く。
塩を水に溶かすと、塩はそのイオンに解離する。
この解離は、溶解度定数によって完全解離と不完全解離があります。
しかし、弱酸や弱塩基の塩を水に溶かすと、水は塩をイオン化して、水酸化物アニオンとヒドロニウムカチオンを形成することができます。
また、塩はその陽イオンと陰イオンに分離する。
これを塩の加水分解という。
ハイドレーションとは
水和とは、水分子が物質と結合する化学プロセスのことである。
有機化学では、不飽和化合物であるアルケンやアルキンに水分子が付加することを水和という。
しかし、無機化学では、水和は水分子が化合物と結合することを意味する。
有機化学では、不飽和が存在するところに水分子が付加される。
ここで、水分子はプロトンと水酸化物アニオンに開裂する。
水酸化物アニオンは、置換基が多い方の炭素原子と結合を形成する。
プロトンはマルコフニコフの法則に従って、置換基の少ない方の炭素と結合する。
不飽和の有機分子はすべて水和の影響を受けやすい。
無機化学では、無機化合物に水分子が結合することを水和という。
例えば、イルメナイト砂から酸化チタン顔料(FeTiO3)を製造する硫酸塩法では、副産物としてFeSO4が生成される。
この水和を介した結晶化による副生成物。
ここで、FeSO4.7H2Oは、FeSO4と水との反応後、10℃まで冷却することによって生成される。
そして、容易に取り出すことができるFeSO4.7H2Oの結晶が形成される。
この結晶は硫酸第一鉄七水和物です。
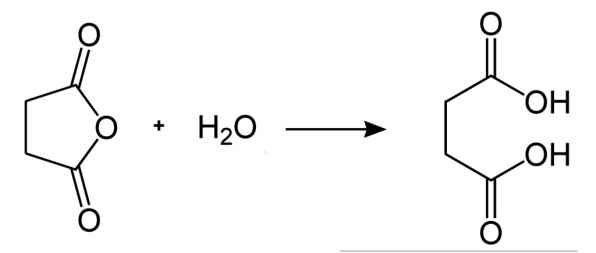 図2:水和したナトリウムカチオンと塩化物アニオン
図2:水和したナトリウムカチオンと塩化物アニオン
水和は、乾燥剤に生じる化学的プロセスです。
乾燥剤とは、水蒸気を吸収することができる化合物のことである。
さらに、水和という言葉は、ナトリウムイオンのような塩類イオンの溶解を説明するためにも使われる。
塩を水に溶かすと、塩は陽イオンと陰イオンに解離する。
この陽イオンと陰イオンは、水分子による水和によって互いに分離される。
ここで、水分子が塩イオンを取り囲むことになるが、これを水和という。
加水分解と水和の違い
定義
加水分解:加水分解は、水を反応物の1つとする二重分解反応です。
水和反応。
水和は、水分子が物質と結合する化学的過程です。
化学結合
加水分解:水分子の結合が切断されることで加水分解が起こる。
水和。
有機分子の水和は結合の開裂で起こるが、無機化合物では開裂は起きない。
自然
加水分解:加水分解により不飽和化合物から飽和化合物を生成する。
水和 水和:脱水した化合物から水和した化合物を生成する。
結論
加水分解と水和は、学生がよく混同する2つの異なる用語です。
加水分解と水和の主な違いは、加水分解は水分子の分裂を含むのに対し、水和は必ずしも水分子の分裂を含まないことである。
