主な違い – エタノールの燃焼反応と酸化反応
エタノールは、分子式C2H5OHで表されるアルコールです。
エタノールの化学式はCH3CH2OHです。
エタノールは燃焼反応を起こすことができるため、燃料として利用されています。
また、酸化反応によりアルデヒド型やカルボン酸型に変化することもあります。
エタノールの燃焼反応と酸化反応の大きな違いは、エタノールの燃焼反応では必ず熱と光が発生するのに対し、エタノールの酸化反応では必ずしも熱と光が発生しないことである。
主な対象分野
- エタノールの燃焼反応とは?
– 定義、物性、反応 - エタノールの酸化反応とは?
– 定義、性質、反応 - エタノールの燃焼反応と酸化反応の違いとは
– 主な違いの比較
Key Terms: Aldehyde, Biofuel, Carbon Dioxide, Carbon Monoxide, Carboxylic Acid, Combustion Reaction, Complete Combustion, Complete Oxidation, Ethanol, Gasoline, Incomplete Combustion, Incomplete Oxidation, Oxidation Reaction
エタノールの燃焼反応とは?
エタノールの燃焼反応とは、エタノールを燃焼させたときに起こる反応のことです。
エタノールは可燃性の高い液体で、燃料として使用することができます。
エタノールを燃焼させると、エネルギーとして熱や光を発生させることができます。
したがって、エタノールの燃焼は発熱反応です。
エタノールが分子状酸素(O2)の存在下で燃焼すると、2つの最終生成物を形成する。
それらは、二酸化炭素(CO2)と水分子(H2O)です。
エタノールの燃焼は、青い炎で示される。
エタノールの燃焼は、エタノールと酸素が結合する単純なプロセスです。
エタノールの燃焼は、2つの方法で起こることがあります。
- 完全燃焼
- 不完全燃焼
完全燃焼では、CO2とH2Oが生成される。
しかし、不完全燃焼では、一酸化炭素(CO)や炭素(C)が生成される。
不完全燃焼は、酸素(O2)が不足した場合に起こります。
エタノールの完全燃焼
CH3CH2OH(l)+3O2(g)→2CO2(g)+3H2O(l)の順で燃焼する。
エタノールの不完全燃焼
CH3CH2OH(l) + 2O2(g) → 2CO(g) + 3H2O(l)
CH3CH2OH(l)+O2(g)→C(s)+3H2O(l)となる。
不完全燃焼のため、一酸化炭素(CO)ガスと炭素(C)ダストが混在していることが多い。
エタノールの燃焼で発生する熱は、自動車エンジンのピストン駆動に利用される。
また、エタノールはロケットの燃料としても利用できる。
また、エタノールは植物のバイオマスからバイオ燃料として生産することができる。
そのため、エタノールは化石燃料よりも環境に優しい性質を持っています。
エタノールはガソリンの添加剤としても優れている。
エタノールをガソリンに混ぜると、大気汚染物質の排出をある程度防ぐことができる。
しかし、エタノールは燃やすと炎を出し、汚染物質を放出する。
エタノールの酸化反応とは?
エタノールの酸化反応とは、エタノールが酸化剤によって酸化されることによって起こる化学反応です。
エタノールを酸化すると、第一生成物としてエタナールというアルデヒドが生成されます。
さらに酸化されるとカルボン酸の形になり、エタン酸と呼ばれるようになる。
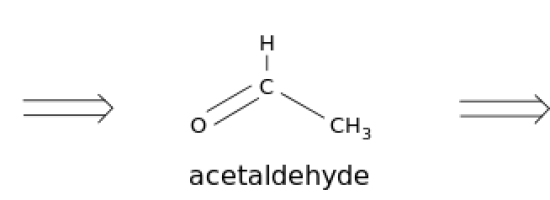 図2: エタノールの酸化
図2: エタノールの酸化
しかし、エタノールの酸化は、触媒の存在下でも起こりうる。
この触媒は、酸化反応の活性化エネルギーを小さくするために使われる。
活性化エネルギーが高ければ、反応は開始されない。
酸化には2つの段階があります。
- 完全酸化
- 不完全酸化
エタノールの完全酸化では、最終生成物としてエタン酸が生成される。
エタノールの不完全酸化では、最終生成物としてエタナールが生成される。
どちらの酸化でも副産物として水分子(H2O)が生成される。
エタノールの完全酸化
エタノール+酸素 → エタナール+水 → エタン酸+水
CH3CH2OH(l) + [O] → CH3CHO(l) + H2O(l) → CH3COOH(l) + H2O(l)
エタノールが完全に酸化されると、反応の最後にエタン酸が生成されます。
しかし、エタノールの酸化はまずエタナールを生成し、さらにエタナールが酸化されてエタン酸になる。
エタノールの不完全な酸化
エタノール+酸素 → エタナール+水
CH3CH2OH(l) + [O] → CH3CHO(l) + H2O(l)
上の式で、[O]は酸化剤に由来する原子状酸素を示します。
例として、硫酸(H2SO4)と共に重クロム酸ナトリウム(Na2Cr2O7)を酸化剤として使用した場合を考えてみましょう。
CH3CH2OH(l) + Na2Cr2O7(aq) + H2SO4(aq) → CH3CHO(l) + 2NaCrO4(aq) + 2H2O(l) となります。
エタノールの酸化には、触媒か酸化剤のどちらかが必要である。
しかし、エタノールの酸化では、エネルギー形態として熱や光は発生しない。
エタノールの酸化には、触媒を用いる方法もあります。
銀触媒はそのような触媒です。
500℃の銀触媒上にエタノール蒸気と空気の混合物を通すと、エタノールが酸化される。
その結果、水(H2O)と共にエタナールが生成される。
エタノールの燃焼反応と酸化反応の違い
定義
エタノールの燃焼反応。
エタノールの燃焼反応とは、エタノールを燃焼させたときに起こる反応です。
エタノールの酸化反応。
エタノールの酸化反応とは、エタノールが酸化剤によって酸化されるときに起こる化学反応であり、エタノールが酸化剤によって酸化されると、エタノールの酸化反応が起こる。
酸化剤
エタノールの燃焼反応。
エタノールの燃焼反応では、酸化剤を必要としない。
エタノールの酸化反応 エタノールの酸化反応には、酸化剤が必要である。
触媒
エタノールの燃焼反応。
エタノールの燃焼反応には触媒を必要としない。
エタノールの酸化反応 エタノールの酸化反応は、触媒の存在下でも起こりうる。
最終製品
エタノールの燃焼反応。
エタノールの酸化反応による最終生成物は、CO2、CO、C、H2Oとなる。
エタノールの酸化反応。
エタノールの燃焼反応による最終生成物は、H2Oとともにエタナールまたはエタン酸のいずれかとなります。
エネルギー形態
エタノールの燃焼反応 エタノールの燃焼反応により、熱や光を発生させることができる。
エタノールの酸化反応。
エタノールの酸化反応では、熱や光を発生させることができない。
結論
燃焼の最終生成物は常に酸化種であるため、燃焼は酸化反応でもあります。
さらに、燃焼は出発物質と酸素の結合を伴う。
このことからも、燃焼は酸化反応であることがわかる。
このように2つの現象には類似性があるが、エタノールの燃焼反応と酸化反応の違いを見分けることができる明確な性質があります。
