主な違い – マグネシウムと酸化マグネシウムの違い
マグネシウムは、元素の周期表の第2族に属するアルカリ土類金属です。
多くの基本的な化合物を形成することができます。
マグネシウムは2価の陽イオンを形成してイオン性化合物を形成することが多い。
酸化マグネシウムはそのようなイオン化合物の一つです。
白色の固体です。
マグネシウムと酸化マグネシウムの主な違いは、マグネシウムが化学元素であるのに対し、酸化マグネシウムはイオン性化合物であることである。
マグネシウムとは
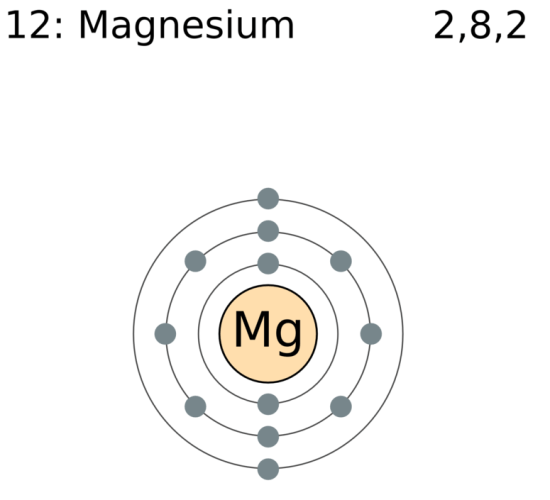
マグネシウムは、Mgの記号を持つ化学元素です。
元素周期表の第2族第3周期に属する。
マグネシウムの原子番号は12です。
これは、マグネシウムが原子核に12個の陽子を持つことを意味する。
室温と圧力の条件では、マグネシウムは固相です。
マグネシウムの電子配置は[Ne]3s2です。
そのため、0と+2の酸化状態を持つことができる。
図1: マグネシウムの化学構造
マグネシウムの融点は約650oCです。
マグネシウムの原子質量は24amuとされている。
周期表ではsブロックに属します。
マグネシウムと同じグループの他の元素は、アルカリ土類金属とみなされます。
これは、それらが形成する酸化物が基本的な性質を持つためです。
マグネシウムの電気陰性度は約1.31です。
マグネシウムの原子半径は約160pmです。
マグネシウムは主に鉱床で見つけることができます。
そのような鉱物には、ドロマイトやマグネサイトがあります。
海水にも相当量のマグネシウムイオンが溶けている。
マグネシウムは金属として、特に航空機の設計や自動車の設計など、幅広い用途に使われています。
酸化マグネシウムとは
酸化マグネシウムは、化学式MgOで表される無機化合物です。
モル質量は40.304g/mol。
白い粉末で吸湿性があります。
これは、大気にさらされると空気中の水分を吸収することができることを意味します。
酸化マグネシウムは無臭で、沸点は3600oC。
融点は約2800oC。
酸化マグネシウムの飽和溶液のpH値は10.3です。
したがって、塩基性化合物です。
 :図2 酸化マグネシウムのサンプル
:図2 酸化マグネシウムのサンプル
酸化マグネシウムは、マグネシウムイオンと酸化物イオンが格子状に結合したイオン性化合物です。
陽イオンと陰イオンの間にイオン結合が存在する。
この化合物を水に加えると、水酸化マグネシウムになります。
しかし、水酸化マグネシウムを加熱すると、再び酸化マグネシウムを与える。
酸化マグネシウムは、炭酸マグネシウムや水酸化マグネシウムを焼成することによって作ることができる。
マグネシウムと酸化マグネシウムの違い
定義
マグネシウム。
マグネシウムは化学元素で、記号は Mg。
酸化マグネシウム。
酸化マグネシウムは、化学式 MgO で表される無機化合物です。
モル質量
マグネシウム マグネシウムのモル質量は24g/molです。
酸化マグネシウム。
酸化マグネシウムのモル質量は40.304 g/molです。
自然
マグネシウム マグネシウムは化学元素の一種である。
酸化マグネシウム。
酸化マグネシウムは、イオン化合物です。
融点
マグネシウム マグネシウムの融点は約650℃です。
酸化マグネシウム。
酸化マグネシウムの融点は約2800℃です。
外観
マグネシウム マグネシウムは、光沢のある銀灰色の外観を有する。
酸化マグネシウム。
酸化マグネシウムは、白色の粉末です。
結論
マグネシウムは化学元素であり、酸化マグネシウムはイオン性化合物です。
これがマグネシウムと酸化マグネシウムの大きな違いです。
マグネシウムは、軽い割に強度があるため、非常に有用な金属元素です。
