共有結合性の物質には、極性分子と非極性分子の両方が存在する。
共有結合性分子には、極性を持つものと持たないものがあります。
極性分子と非極性分子は互いに異なる方法で相互作用する。
極性分子は双極子-双極子相互作用のような力によって相互作用しますが、非極性分子はロンドン分散力によって相互作用します。
自然界でこれらの分子がどのように異なり、どのように相互作用しているのかを見てみましょう。
この記事で解説しています。
- 極性分子とは何か?
– 定義、特徴、例 - 非極性分子とは?
– 定義、特徴、例 - 極性分子と非極性分子はどのように相互作用するか?
極性分子とは
極性分子は、分子内の電子が非対称に分散したものです。
共有結合は、2つの原子の間で2つの電子を共有することによって形成されます。
これらの原子は、同じ元素のものでも、異なる2つの元素のものでもよい。
2つの異なる元素が関与している場合、電気陰性度(電子を引き寄せる能力)が似ている場合もあれば、異なる電気陰性度を持つ場合もあります。
2つの原子の電気陰性度の差が0.4<の場合、電気陰性度の高い原子が共有する一対の電子を自分の方に引き寄せる傾向が強くなります。
そのため、もう一方の原子はわずかに正電荷(δ+)のまま、わずかに負電荷(δ-)が誘起されます。
この過程を偏光と呼びます。
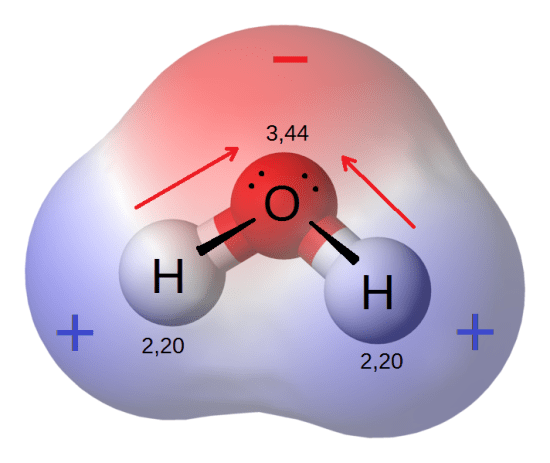 : 図1: 水分子の永久双極子
: 図1: 水分子の永久双極子
水分子は極性分子の代表格です。
酸素原子と水素原子の電気陰性度の差は1.5であるため、2個の電子は電気陰性度の高い酸素原子の方に引き寄せられます。
従って、水分子は極性を持つと言われています。
他の極性分子の例としては、アンモニア(NH3)、硫化水素(H2S)、二酸化硫黄(SO2)などがあります。
非極性分子とは?
非極性分子は、電子が対称的に分布しているため、電荷の分離がない。
基本的には、電気陰性度の近い2つの原子が一緒になって共有結合を作るときに起こる。
したがって、2つの原子が共有する1組の電子は、参加する原子のいずれにもほとんど偏らない。
このような分子では、電荷の分離は見られない。
しかし、電荷分離があっても、分子の形状によって電荷が打ち消されるものがあります。
CO2がその典型的な例です。
 :図2 二酸化炭素のルイス構造
:図2 二酸化炭素のルイス構造
C原子とO原子の間に極性結合を構成するのに十分な電気陰性度の差があるにもかかわらず、分子の形状が直線的であるために電荷は相殺され、正味の双極子はゼロとなる。
従って、二酸化炭素分子は非極性分子とみなされる。
非極性化合物の例としては、N2、Cl2、O2などの2原子気体分子が主に挙げられる。
炭化水素系液体もほとんどの場合、非極性です。
トルエン、ガソリン、ペンタン、ヘキサンなどがその例です。
極性分子と非極性分子の相互作用は?
2種類の分子は互いに異なる相互作用をします。
極性分子同士の相互作用について
 図3: 2つのHCl分子間の双極子-双極子相互作用
図3: 2つのHCl分子間の双極子-双極子相互作用
極性分子同士は、双極子-双極子相互作用のような力によって相互作用する。
極性分子は、電子の分散が非対称であるため、電荷の分布が不均一であることは前述した。
そのため、ある極性分子のわずかにプラス側の端は、別の極性分子のわずかにマイナス側の端に引き寄せられる。
上の図(3)は、この相互作用を明確に示している。
一方の分子のわずかに正のH原子は、他方の分子のわずかに負のCl原子に引き寄せられる。
2つの分子間の引力は、双極子-双極子相互作用として知られています。
双極子-双極子相互作用には、水素結合と呼ばれる特殊なものがあります。
この相互作用には、水素供与体という分子の電気陰性度の高い原子が関与しており、その原子は水素を供与して、他の分子の電子の一対を持つ電気陰性度の高い原子と結合を形成している。
後者は水素アクセプターと呼ばれる。
下図は、水における水素結合の様子を示しています。
図4: 水中の水素結合
Bと書かれた酸素原子は、酸素原子Aから水素を受け取って、2つの水分子の間に結合をつくっています。
酸素原子Aが水素供与体であるのに対し、酸素原子Bは水素受容体です。
非極性分子はどのように相互作用するか
非極性分子は双極子-双極子相互作用を形成することができない。
非極性分子は双極子-双極子相互作用を形成できず、ロンドン分散力を形成して相互作用する。
Electrons of a molecule move randomly. When the electrons are collected towards one end of the non-polar molecule, a slight negative charge is induced at that particular end. It makes the other end of the molecule slightly positive. This leads to a temporary charge separation on the molecule. When another non-polar molecule comes to the neighbourhood, the former molecule has the ability to induce a dipole on the latter as well. This occurs due to the repulsion of like charges.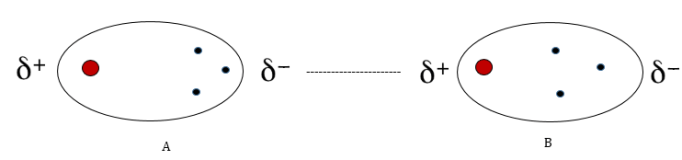
分子Aのマイナス端の電子密度が、隣接する分子Bの電子を反発させ、その端にプラスの電荷が発生する。
このとき、両末端に弱い結合が形成される。
極性分子と非極性分子の相互作用
ロンドン分散は、極性分子の双極子-双極子力よりもはるかに弱いと言われている。
したがって、極性分子が非極性分子と相互作用する傾向は最小です。
なぜなら、極性分子と非極性分子の間で分散力が形成される際に放出されるエネルギーは、極性分子間の強い双極子-双極子相互作用を破壊するには十分でないからです。
したがって、非極性溶質は極性溶媒に溶解することができない。
Kurtus, Ron. “極性分子と非極性分子” Understanding Chemistry: School for Champions. N.p., n.d. Web. 07 Feb. 2017.
“なぜ極性化合物と非極性化合物は互いに溶解しないのですか?”. Chemistry Stack Exchange. N.p., n.d. Web. 07 Feb. 2017.
“Dipoli acqua” By Riccardo Rovinetti – Own work (CC BY-SA 3.0) via Commons Wikimedia
“Carbon-dioxide-octet-dot-cross-colour-coded-2D” By Ben Mills – Own work (Public Domain) via Commons Wikimedia
“Dipole-dipole-interaction-in-HCl-2D” By Benjah-bmm27 – 自作 (Public Domain) via Commons Wikimedia
“水素結合-水-2D” (パブリックドメイン) via Commons Wikimedia
