主な相違点 – ボンドペアとローンペア
すべての元素は、原子の中に電子を持っています。
これらの電子は、原子核の外側に位置する殻の中にあります。
1 つの殻には 1 つまたは複数の軌道があります。
原子核に最も近い軌道は、s軌道、p軌道、d軌道です。
1つの軌道はいくつかのサブ軌道に分けることができる。
1つの副軌道には最大2個の電子を保持することができる。
電子が1個もない場合は空軌道と呼ばれます。
副軌道に1個の電子があるとき、それは不対電子と呼ばれます。
副軌道が最大2個の電子で満たされている場合、それは電子ペアと呼ばれます。
電子対には、結合対と孤立対の2種類があります。
ボンドペアとローンペアの主な違いは、ボンドペアは結合している2つの電子で構成されているのに対し、ローンペアは結合していない2つの電子で構成されていることです。
ボンドペアとは
結合対とは、結合している電子の対のことです。
一つの結合は必ず二つの電子が対になって構成されています。
この2つの電子を合わせて結合ペアと呼びます。
結合対は共有結合化合物と配位結合化合物で見ることができます。
共有結合化合物では、共有結合は結合対で構成されています。
配位化合物では、配位結合が結合対で構成されている。
配位化合物では、配位子がその孤立電子対を中心の金属原子に提供する。
単独電子対であったにもかかわらず、供与後は共有結合に近い配位結合を形成するため、結合対とみなされる。
これは、2つの電子が2つの原子の間で共有されているためです。
共有結合では、2つの原子がその不対電子を共有して対になる。
この電子のペアを結合ペアと呼びます。
二重結合や三重結合がある場合、それぞれの結合ごとに結合対が存在する。
例えば、二重結合がある場合、結合対は2つあります。
共有結合は2つの原子の軌道の混成によって形成されるので、結合対は混成軌道に存在する。
この混成軌道は、シグマ結合とπ結合のいずれかを形成することができる。
したがって、結合対はシグマ結合でもπ結合でも観察することができる。
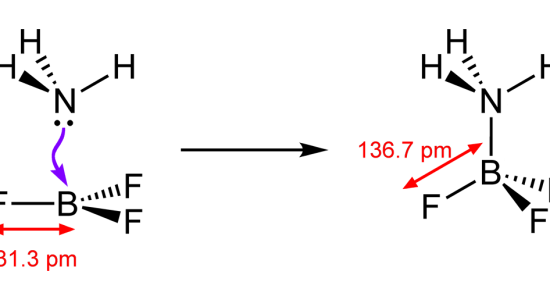 : NH3 と BF3 の配位結合の例
: NH3 と BF3 の配位結合の例
上の例では、NH3分子のN原子上の電子対がBF3分子のB原子に供与される。
その後、配位結合は共有結合のように見える。
したがって、電子対は結合対になりました。
ローンペアとは
ローンペアとは、結合していない電子の対のことです。
ローンペアの電子は、同じ原子に属しています。
したがって、ローンペアは非結合電子対とも呼ばれます。
最内殻の電子も結合しており、結合に関与していませんが、ローンペアとはみなしません。
原子の価電子のうち、互いに結合しているものは、ローンペアとみなされる。
これらの孤立対は、空の軌道を持つ別の原子に供与されることもあります。
その場合、配位結合を形成する。
それ以降は、結合対となるため、ローンペアとはみなされません。
ある元素は1つしかローンペアを持ちません。
また、複数の孤立ペアを持つ元素もあります。
例えば、窒素(N)は最大で3つの共有結合を形成することができます。
したがって、3個の電子は他の原子と共有して結合を形成し、残りの2個の電子は孤立対として残ります。
しかし、ハロゲンは最外周の軌道に7個の電子を持っています。
したがって、ハロゲンは3個の単独ペアと1個の不対電子を持っています。
したがって、ハロゲンはこの1個の不対電子を共有することで、1個の共有結合を持つことができます。
ローンペアは、分子内の結合の角度を変えます。
例えば、2つの結合を持つ中心原子からなる直鎖状分子を考えてみましょう。
もし、ローンペアがなければ、この分子は線状分子のままです。
しかし、中心原子に1つ以上のローンペアがあると、分子は線形でなくなってしまう。
ローンペアが引き起こす反発のために、結合のペアが反発する。
そうすると、分子は直線的ではなく、角張ったものになる。
上の図のように、アンモニアには1つ、水分子には2つ、HClには3つのローンペアがあります。
原子が空の軌道を持つ場合、ローンペアは軌道の混成によって不対電子に分割され、結合に参加することができます。
しかし、空の軌道がなければ、ローンペアは電子のペアとして残り、結合に参加することはありません。
例えば、窒素(N)は一番外側の軌道に5個の電子が存在する。
2個の電子は2s軌道に、残りの3個は3個のp軌道にあります。
窒素には空の軌道がないので、2s軌道の電子対はローンペアとして残ります。
しかし、リン(P)も一番外側の軌道に5個の電子を持っています。
2個の電子が3s軌道に、残りの3個の電子が3p軌道にあります。
しかし、リンは最大5つの結合を形成することができます。
これは、3d軌道が空だからです。
図4:リンの軌道図と混成の可能性
リンはsp3d1混成軌道に5個の電子を含めることで、5つの結合を持つことができる。
そして、リンにはローンペアが存在しない。
Bond PairとLone Pairの違い
定義
ボンドペア。
ボンドペアは、結合している電子のペアです。
ローンペア。
結合していない電子のペア。
ボンディング
ボンドペア。
ボンドペアは常に結合している。
ローン・ペア(Lone Pair)。
単独ペアは結合を形成しないが、単独ペアを提供することによって結合を形成することができる(配位結合)。
原子
ボンドペアのこと。
2個の電子が2個の原子に属している結合ペア。
ローンペア。
2つの電子が同じ原子に属しているもので、ローンペアと呼ばれる。
原点
結合対。
2つの原子が電子を共有することで結合対が発生する。
ローンペア。
空の軌道がないために発生する。
結論
ボンドペアとローンペアは、結合した電子を表す用語です。
これらの電子対は、化合物の反応性、極性、物理的状態、化学的性質を引き起こします。
イオン性化合物は、結合対と孤立対を持つことも持たないこともあります。
共有結合化合物と配位化合物は、基本的に結合対を持つ。
共有結合化合物や配位化合物は、基本的に結合対を持ち、孤立対を持つことも持たないこともあります。
結合対と孤立対の違いは、結合対は結合している2個の電子で構成されているのに対し、孤立対は結合していない2個の電子で構成されていることである。
