主な違い – 溶液 vs 懸濁液
溶液と懸濁液は、どちらも混合物として扱われます。
溶液と懸濁液の主な違いは、その粒子の大きさです。
溶液中の粒子は懸濁液のそれよりもはるかに小さいです。
この溶質粒子と懸濁液粒子の違いにより、この2つの系には明確な違いがあります。
しかし、両者の成分は化学的に結合しておらず、その大きさ、溶解度、密度などの物理的特性によって分離することができます。
本稿では、この点について説明する。
-
溶液とは何か?
– 定義、特徴、例 -
懸濁液とは?
– 定義、特徴、使用例
解決策とは何か – 定義、特徴、例
溶液とは、2つの物質の均質な混合物です。
システムの最も豊富な成分は、溶媒として知られているのに対し、溶質は、溶液中に溶解している物質です。
溶質の粒子は、原子または分子レベルです。
溶質粒子の大きさは通常1 nm未満です。
溶媒と溶質は同じ相にあり、光学顕微鏡で見ても区別がつかない。
溶液の均質性は、溶質が溶媒中に均一に分散していることから生じる。
溶液系の成分は、懸濁液やコロイドに比べて分離が比較的困難です。
例:NaClは白色の固体です。
これを水に溶かすと、白い固体は見えなくなる。
代わりに、透明な溶液が見えるだけです。
溶液が透明なのは、溶質の粒子が小さく、光の反射や散乱を防いでいるためです。
溶液は、ある温度では安定で、粒子が沈降することなく均質な状態を保ちます。
溶液の形成は、溶質と溶媒の親和性に依存する。
極性溶質は極性溶媒にのみ溶解し、非極性溶質は非極性溶媒にのみ溶解する。
極性溶媒として最も知られているのは水です。
塩、砂糖、塩化カリウムのような極性溶質は容易に溶解する。
ベンゼン、ヘキサン、石油エーテルなど、ほとんどの有機溶媒は非極性です。
非極性溶媒の例として、ヨウ素や発泡スチロールを挙げることができる。
溶液の例として次のようなものがあります。
気体の中の気体 空気
気体中の液体:ソーダ
液体中の液体。
液体の中の固体: 水中のNaCl
固体の中の液体 水銀アマルガム、銀の中の水銀
固体の中の固体 合金、鉄、真鍮、青銅
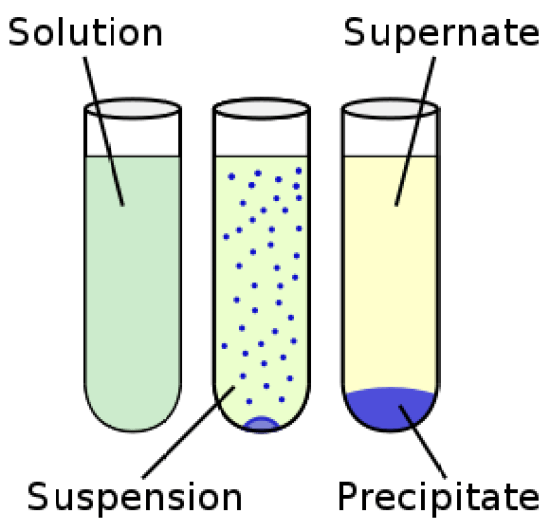
サスペンションとは – 定義、特徴、例
懸濁液の粒子は、多くの場合1000 nm以上です。
したがって、懸濁液は不均質です。
懸濁液は単一相ではありません。
土壌を水と混合すると、大きな土壌粒子がはっきりと見え、水と区別することができます。
この系は典型的な懸濁液です。
懸濁液中の粒子は媒体中を移動する傾向があり、時間とともに沈降が起こります。
粒子が大きいため、ろ過によって簡単に分離することができます。
懸濁液は粒子径が大きいため、溶液とは異なり白濁しています。
光はこれらの粒子によって散乱または反射される。
サスペンションの多くは、固体粒子を液体に懸濁させたものである(例:泥水、CaCO3水溶液)。
しかし、液-液懸濁(油中/水中水銀)、固-気懸濁(空気中煤煙)などが発生することもあります。
エマルションは、混じり合わない2つの液体を振って、濁った混合物を作る懸濁液の一種である。
これを放置しておくと、2つの液体層が分離しているのが容易に確認できる。
油と水が一緒になったものは、エマルジョンの立派な一例です。
経口薬の中には、懸濁液として利用できるものがあります。
例えば、制酸剤に使われるマグネシアミルクは、水酸化マグネシウムの懸濁液です。
懸濁液は一相ではありません。
しばらく放置しておくと相分離することがあります。
従って、これらは安定ではない。
溶液と懸濁液の違い
組成
溶液。
溶液は均質である(組成が全体的に同じである)。
溶質粒子は溶媒に溶解し、均一に分散している。
懸濁液。
懸濁液は不均質です。
粒子は目に見えて区別でき、粒子の分散は均一ではない。
粒子径
解答 粒子径は1nm以下です。
原子や分子レベルの比較的小さな粒子です。
光学顕微鏡でも見ることができない。
懸濁液。
粒子径は1000nm以上。
粒子は比較的大きく、肉眼で確認することができる。
凝集体として存在することもあります。
プロパティ
溶液。
溶質と溶媒が同じ相にある。
懸濁液。
浮遊粒子は媒体とは異なる相に存在することができる。
外観
溶液。
溶液は透明です。
光の散乱はない。
懸濁液。
懸濁液は濁っている。
光は反射または散乱することがあります。
例
溶液です。
例:NaCl水溶液、砂糖水溶液など。
懸濁液。
マグネシアミルク、空気中の煤など。
“Solubility of Things: 化学に関するウェブサイト” Solute, solvent, solution definition with examples. Educating Online, n.d. Web. 01 Feb. 2017.
“混合物、溶液、懸濁液”. The Engineering Toolbox. N.p., n.d. Web. 01 Feb. 2017.
Rezabal, Elixabete, and Thomas Schäfer. “極性および非極性溶質の溶媒としてのイオン液体:親和性と配位”. Physical Chemistry Chemical Physics 17.22 (2015): 14588-14597.
“コロイド溶液” Xamplified . N.p., n.d. Web. 01 Feb. 2017.
“懸濁液とコロイド|懸濁液の性質”. Chemistry. ビジュスクラス, 08 Nov. 2016. Web. 01 Feb. 2017.
Shukla, Brajesh. “懸濁液とは何か、その特性について言及する ?”. PreserveArticles.com. N.p., n.d. Web. 01 Feb. 2017.
Volland, Walt. “溶液、コロイド、および懸濁液”. Solutions, colloids, and suspension. N.p., 29 Mar. 2005. Web. 01 Feb. 2017.
“Chemical precipitation diagram” By Vectorized by ZooFari; raster by ZabMilenko – Own work, Chemical precipitation diagram.png (Public Domain) via Commons Wikimedia
“652201” (パブリックドメイン) via Pixabay

