アルファチューブリンとベータチューブリンの主な違いは、アルファチューブリンはほぼ完全にデチロシン化されているのに対し、ベータチューブリンは10%程度しかリン酸化されていないことである。
また、デチロシン化とはαチューブリンの翻訳後修飾の一種であり、βチューブリンのリン酸化はC末端ドメインの441番セリンで行われる。
また、GTPは常にαチューブリンに結合しているが、βチューブリンのGTPはマイクロフィラメントと交換する傾向があります。
アルファチューブリンとベータチューブリンは微小管の2つの主要な構成要素であり、細胞骨格構造を形成する一方で、有糸分裂、繊毛運動、細胞内輸送、細胞の形態や極性の定義など多くの細胞内プロセスに関与する非常に異質な分子です。
αチューブリンとは
アルファチューブリンは、細胞骨格の形成に重要な役割を果たす微小管の2つの構成タンパク質のうちの1つです。
また、微小管は、細胞分裂を含むいくつかの細胞内イベントに関与している。
一般に、αチューブリン、βチューブリンともに、3つの機能ドメインからなる球状タンパク質です。
N末端ドメイン、中間ドメイン、C末端ドメインです。
ここで、N末端ドメインは、5本のαヘリックスと6本の平行なβストランドからなり、ロスマンフォールドを形成している。
GTP分子はN-末端ドメインの基部に位置している。
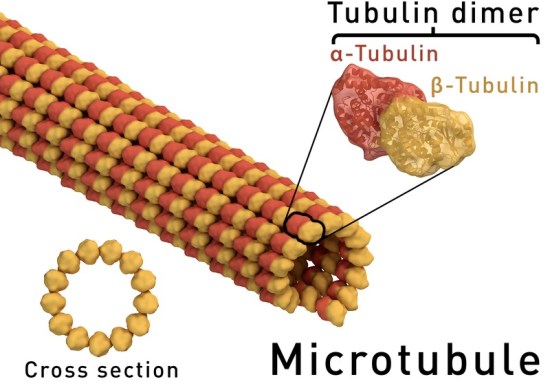 :図1 微小管の構造
:図1 微小管の構造
一方、中間ドメインは、3つのαヘリックス、βシート、さらに2つのヘリックスから構成されている。
これはタキソールの結合ドメインを形成している。
通常、タキソールは低温での解重合や老化に対してシートを安定化させる役割を担うリガンドです。
しかし、C-末端は全体がαヘリックスでできており、他の2つのドメインと重なり合ってプロトフィラメントの「紋章」を形成する役割を担っている。
このため、他の関連タンパク質やモータータンパク質が微小管に結合することができる。
図2: アルファチューブリンとベータチューブリンの構造
さらに、微小管におけるアルファチューブリンの重要性は、GTP分子の結合部位を提供することである。
このGTPは、チューブリン二量体がプラス端に付加されると、加水分解されてGDPになる。
また、GTPの加水分解はアルファチューブリンのE部位で起こる。
この加水分解は、254番目のアミノ酸位置に存在するアスパラギン酸残基によって促進される。
#ベータチューブリンとは
前述したように、βチューブリンは微小管の2番目の構成タンパク質です。
その254番目のアミノ酸位置にリジン残基を持つ。
リジンはNサイトのGTPリン酸基と相互作用することにより、モノマー-モノマー間の相互作用を強化する役割を担っている。
そのため、βチューブリンは微小管の構造を安定化させるのに役立っている。
さらに、GTPはN末端ドメインとは別に、チューブリン分子のE(交換)部位に結合することができる。
しかし、βチューブリン中のGTPは、マイクロフィラメントを重合させるために交換可能である。
αチューブリンとβチューブリンの類似性
- アルファチューブリンとベータチューブリンは、微小管の2つの主要な構造要素です。
- これらは球状タンパク質です。
- また、分子量はどちらも50kDa程度です。
- また、αチューブリン、βチューブリンともに40%の配列相同性があり、その構造は似ています。
- また、α-チューブリンには、α-ヘリックス、β-シート、ランダムコイルが存在する。
- また、αチューブリンには、αヘリックス、βシート、ランダムコイルが存在し、単量体の構造は、αヘリックスに囲まれた2枚のβシートが相互作用することで形成されています。
- また、チューブリンは主に真核生物に存在し、原核生物にはチューブリンと近縁のタンパク質が存在する。
- さらに、いずれのタンパク質も翻訳後修飾を受ける。
- また、GTPはチューブリンが重合して微小管を形成する際に必要なエネルギー源となる。
アルファチューブリンとベータチューブリンの違い
定義
アルファチューブリンは微小管を構成する2つのタンパク質のうちGTPに結合しているものを指し、ベータチューブリンは微小管を構成する2つ目のタンパク質です。
したがって、これがαチューブリンとβチューブリンの根本的な違いです。
構造
アルファチューブリンは13%のアルファヘリックス、39%のベータシート、48%のランダムコイルで構成され、ベータチューブリンは13%のアルファヘリックス、42%のベータシート、45%のランダムコイルで構成される。
このように、アルファチューブリンとベータチューブリンの重要な違いは、その構造です。
第254回 アミノ酸
さらに、αチューブリンとβチューブリンのもう一つの違いは、αチューブリンが254番目のアミノ酸としてアスパラギン酸を含むのに対して、βチューブリンは254番目のアミノ酸としてリジンを含むことである。
第254回 アミノ酸の機能
また、254番目のアミノ酸の働きも、αチューブリンとβチューブリンとで違いがあります。
アルファチューブリンの254番目のアミノ酸は、Eサイトのヌクレオチドの加水分解に理想的な残基として機能し、ベータチューブリンの254番目のアミノ酸は、NサイトのGTPリン酸基と相互作用してモノマー同士の相互作用を強化する。
GTP結合
さらに、GTPはαサブユニットに常に付着しているのに対し、βサブユニットではマイクロフィラメントが重合するためにGTPが交換可能である。
したがって、この点もαチューブリンとβチューブリンの違いと言える。
ポストトランスレーショナルモディフィケーション
特に、αチューブリンとβチューブリンの主な違いは、αチューブリンがほぼ完全にデチロシン化されているのに対し、βチューブリンは10%程度がリン酸化されていることである。
翻訳後修飾の性質
上記の違いから、αチューブリンではC末端のチロシンが除去され、新たに形成されたC末端にグルタミン酸が露出するデチロシン化が行われるのに対し、βチューブリンではC末端ドメインの441番血清にリン酸化が行われる。
つまり、これもαチューブリンとβチューブリンの違いなのです。
結論
アルファチューブリンは、微小管を構成する2つのタンパク質のうちの1つです。
翻訳後修飾により、ほぼ完全にデチロシン化された球状タンパク質です。
また、αチューブリンに結合しているGTPは、チューブリンが重合する際のエネルギー源となる役割を担っている。
一方、βチューブリンは、微小管を構成する2番目のタンパク質です。
また、球状タンパク質であるため、リン酸化を受けることもあります。
βチューブリンの主な機能は、単量体-単量体の相互作用を強化することである。
したがって、αチューブリンとβチューブリンの主な違いは、その構造と機能です。
