主な違い – 化合物 vs 混合物
化合物は、化学的に結合している異なる種類の原子から構成されています。
混合物は、2つ以上の異なる種類の物質(原子、分子、または化合物)が物理的に混ざり合ってできています。
化合物と混合物の主な違いは、化合物が化学的に結合しているのに対し、混合物は結合していないことです。
この記事では、以下のことを説明します。
-
化合物とは?
– 定義、特徴、結合の種類、例 -
混合物とは?
– 定義、特徴、例
What is a Compound – Definition, Characteristics, Types of Bonding, Examples
化合物は元素からできています。
特定の化合物は、化学的に結合している2つ以上の元素から構成されています。
化合物は、構成する元素とは全く異なる場合もあります。
例えば、Naは反応性の高い金属であり、Cl2は有毒ガスです。
しかし、NaClは塩であり、料理に使われる。
また、H2とO2で構成される水もその好例です。
水は気体でありながら液体です。
ある種の化合物では、原子の含有比率が一定で、その化合物に固有のものです。
もし、その割合が異なれば、新しい化合物が生まれる。
このシナリオは、次のような例で詳しく説明される。
窒素と酸素は、次の2つの化合物を生成する。
N2(g) + O2(g) → 2NO(g) 一酸化窒素または酸化窒素
2NO(g) + O2(g) → 2NO2(g) 亜酸化窒素、または二酸化窒素
酸化窒素と亜酸化窒素は同じ元素で構成されていますが、その組成は異なります。
したがって、2つの異なる化合物を生じます。
化合物は、構成原子間の引力が反発力より大きい場合に形成される。
化合物は一般に、共有結合またはイオン結合によって作られる。
化学結合で化合物を作るとき、エネルギーは取り込まれたり、取り出されたりする。
共有結合
下図のように原子が電子を共有している状態。
このような化合物を共有結合化合物という。
2つの原子が同じように電子を引き寄せている(電気陰性度が同じ)場合、その化合物は無極性です。
しかし、2つの原子の電気陰性度の差が大きいと、その化合物は極性を持つようになる。
水の分子はこの現象の最たる例です。
非極性化合物 – メタン、アンモニア、ヘキサン
Polar Compounds – Water, CF, HF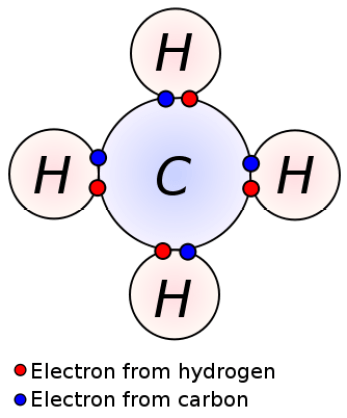
イオン結合
電子は、一方の原子から他方の原子へと完全に移動する。
したがって、結合に関与している両方の原子に電子的な電荷が現れる。
このような結合から生まれた化合物は、主に融点の高い固体であり、電流を流すことができる。
このような化合物を形成する際には、金属元素と非金属元素が組み合わされる。
化合物の成分は物理的に分離することができない。
化学的手法や電気分解によってのみ分離することができる。
#混合物とは – 定義、特徴、結合の種類
混合物とは、2つ以上の元素および/または化合物の組み合わせです。
これらの成分は一緒に存在しているが、化学的に結合しているわけでも、新しい物質を作っているわけでもない。
例えば、砂と水の混合物は、両成分が化学的に結合しておらず、ろ過によって個々の物質として分離することができる。
その他の物理的な分離方法としては、蒸発、蒸留、クロマトグラフィー、遠心分離、抽出などがあります。
これらの分離法では、混合物中の成分の物理的性質が考慮される。
これらの物理的特性には、密度、サイズ、溶解度などがあります。
化合物中の成分は、それぞれの特性を保持している。
塩分を含んだ水溶液を味わうと、舌の上に塩辛さを感じる。
これは、塩が水と混ざっても、その特徴的な味を出すことができることを示している。
混合物には、化合物のような固有の性質はありません。
混合物には、均質なものと不均質なものがあります。
均質な混合物 – 混合物の組成は全体的に同じです。
例:塩が水に溶けている状態
不均質な混合物 – 混合物中の点によって組成が異なる場合があります。
例:スモッグ
私たちが呼吸する空気と広大な青い海は、地球上で見られる最大の混合物であると考えることができます。
どちらも不均質な混合物です。

化合物と混合物の違い
ボンド
化合物。
成分が化学的に結合しているもの。
例:NaCl、H2O
混合物。
成分は化学的に結合していない。
例:塩水、砂、砂糖
分離
化合物。
物理的に分離できない成分。
電気分解で分離できる。
混合物。
濾過、クロマトグラフィー、遠心分離、透析、蒸発、蒸留などの方法により、物理的に容易に分離することができる。
特徴
化合物 化合物は、成分の個々の特徴ではなく、それ自身の特徴を示す。
混合物。
化合物自身の特性は表示されない。
成分の個々の特徴が表示されます。
比率
化合物。
成分比は一定。
混合物。
成分の比率が変化するもの。
沸点・融点
化合物のこと。
沸点、融点は化合物によって一定です。
混合物。
沸点、融点が一定でない。
エネルギー移動
化合物 エネルギーを出したり、入れたりして、化学結合で化合物を作る。
混合物。
エネルギー移動がない、または少ない。
カテゴリー
化合物。
化合物には共有結合のものとイオンのものがあります。
混合物。
混合物には均質なものと不均一なものがあります。
“我々の目的” 混合物と化合物の区別(理論): Class 9 : Chemistry : Amrita Online Lab. N.p., n.d. Web. 31 Jan. 2017.
Ophardt, Charles. ” イオン性化合物入門”. Virtual Chembook. エルムハートカレッジ、2003年。
“Covalent” By DynaBlast – Created with Inkscape (CC BY-SA 2.5) via Commons Wikimedia
“SaltInWaterSolutionLiquid” By Chris 73 / Wikimedia Commons (CC BY-SA 3.0) via Commons Wikimedia
保存方法
