主な違い – 原子半径とイオン半径の比較
原子は物質の構成要素です。
すべての物質は原子で構成されています。
これらの原子は、外部から1個以上の電子を加えることでイオンに変化します。
原子やイオンは円形の立体構造であるため、原子やイオンの半径を測定することができます。
しかし、それは簡単なことではありません。
なぜなら、原子やイオンは電子が移動して構成されているからです。
原子の半径は、原子の原子核から電子雲の境界までの距離です。
イオン半径とは、原子のイオンの半径のことです。
イオンの半径は、イオンの電荷によって、原子の半径よりも大きくも小さくもなります。
原子半径とイオン半径の主な違いは、原子半径が中性原子の半径であるのに対し、イオン半径は電荷を帯びた原子の半径であることである。
原子半径とは
原子半径とは、原子の原子核から電子雲の境界までの距離のことです。
言い換えれば、原子核から、その原子に属する最も遠い電子までの距離です。
原子半径は、孤立した原子と中性原子に対してのみ定義することができる。
元素の周期表で考えると、元素の原子半径にはパターンがあります。
周期表に沿って、原子番号が徐々に小さくなっている。
同じ周期にある元素は、電子殻の数が同じです。
電子の数が多ければ、電子と原子核の間の引力も強くなる。
周期の初期には、一番外側の軌道に存在する電子の数が少なくなっています。
すると、原子核からの引力が小さくなる。
そのため、原子は大きく、原子半径も大きくなる。
しかし、周期に沿って移動すると、原子核の陽子の数が増え、原子に存在する電子の数も増えます。
そのため、電子と原子核の間に働く引力が大きくなる。
そのため、電子と原子核の間の引力が大きくなり、原子の大きさが小さくなり、原子半径が小さくなる。
同様に、周期に沿って移動すると、原子の大きさは徐々に小さくなり、原子半径も小さくなる。
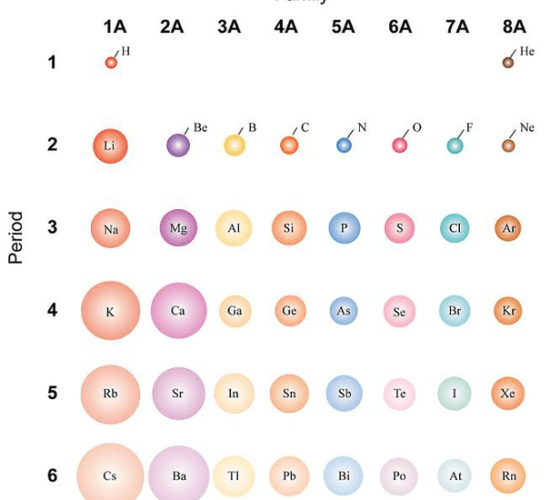 : 図1: 原子の大きさの比較
: 図1: 原子の大きさの比較
元素の周期表で下のグループに進むと、原子半径は大きくなる。
周期が進むごとに、原子の電子殻は1つずつ増えていく。
そのため、原子団を下降させると、原子の大きさが大きくなる。
原子半径も大きくなる。
しかし、dブロックの元素では、同じ周期で隣り合う2つの元素の原子の原子半径にそれ以上の差はない。
これは、ここの電子は内周軌道として位置する同じd軌道に付加されているからです。
最外殻が一定であるため、それらの元素の原子半径に大きな差は生じない。
イオニックラジアスとは
イオン半径とは、原子のイオンの半径のことです。
イオンは単独で存在することはできません。
正電荷のイオンであれば、負電荷のイオン(またはその逆)と反応し、安定な中性化合物となる。
この化合物は、イオン成分でできているので、イオン化合物と呼ばれます。
イオン性化合物は、陽イオンと陰イオンから構成されています。
陽イオンは原子から電子を1個以上取り除いてできるため、大きさは小さくなります。
陰イオンは、原子核に反発する余分な電子を持つため、原子核と電子雲の最も遠い電子との間の距離が長くなり、サイズが大きくなります。
イオン半径を求める最も正確な方法は、2つのイオンの原子核間の距離をその大きさに応じて分割することです。
例えば、原子番号が3倍の陽イオンと陰イオンからなるイオン化合物の場合、陽イオン半径を求めるには、2つの原子核の距離を4で割ればよい。
図2:いくつかの元素の原子半径とイオン半径
同じ化学元素のイオンでも、電荷の違いによって大きさが異なることがあります。
イオン半径を求める最も一般的な方法は、X線結晶構造解析です。
イオン半径も原子半径と同じように周期表で傾向があります。
周期表で下のグループに行くほど、イオン半径は大きくなります。
これは、周期が下降するごとに新しい電子殻が追加されるためです。
また、周期に沿って、原子核からの有効な正の引力が徐々に増加するため、イオン半径は減少する。
原子半径とイオン半径の違い
定義
原子半径。
原子半径は、中性原子の半径です。
イオン半径。
イオン半径は、原子のイオンの半径です。
計算方法
原子の半径。
原子半径は、原子の原子核から電子雲の境界までの距離として計算することができます。
イオン半径。
イオン半径は、2つのイオンの原子核間の距離を大きさで割って算出する。
サイズ
原子半径。
同じ元素の中性原子は同じ大きさなので、原子半径は互いに等しくなる。
イオン半径。
陽イオンは陰イオンに比べて原子半径が小さい。
決定事項
原子半径。
原子半径は、化学元素の中性気体原子を対象として決定される。
イオン半径。
イオン結合している陽イオンと陰イオンを考慮し、決定する。
結論
化学元素の原子半径とイオン半径は、元素の周期表において傾向があります。
周期表に沿った原子サイズやイオンサイズの増減は、元素の電子配置を利用して説明できる。
しかし、原子半径とイオン半径にはかなりの違いがあります。
原子半径とイオン半径の主な違いは、原子半径が中性原子の半径であるのに対し、イオン半径は電荷を帯びた原子の半径であることだ。
