主な違い – 原子と分子
原子は分子の構成要素です。
私たちの身の回りのものはすべて、分子か原子のどちらかでできています。
今回は、原子と分子の違いについて、その化学的性質と物理的性質について説明します。
原子は元素の最小構成要素であるのに対し、分子は2つ以上の原子からできています。
この記事では、原子と分子について説明します。
1. What is an Atom
– Definition, Structure, Properties
2. What is a Molecule
– Definition, Structure, Ionic Bonds, Covalent Bonds
3. What is the difference between Atom and Molecule
原子とは何か
原子は元素の最小構成要素であり、その元素に関連する化学的特性を示すと定義される。
原子はさらに陽子、中性子、電子に分解されるが、これらの素粒子を分離しても元素の化学的特性は現れない。
ある元素の原子は、ほとんどの場合、決まった数の電子、陽子、中性子を含んでいる。
炭素原子は、6個の陽子、6個の電子、6個の中性子を含んでいます。
この素粒子の組み合わせは12Cにしかない。
しかし、元素には同位体が存在するものがあります。
炭素はそのような元素の一つです。
同位体は、中性子の数が異なります。
これが放射能の原因となります。
原子の質量は主に陽子と中性子で決まり、電子は陽子と中性子に比べてごくわずかな質量しかありません。
陽子は正の電荷を持ち、電子と中性子はそれぞれ負の電荷と中性の電荷を持っています。
原子核は陽子で構成され、陽子は中性の中性子と結合して、同電荷の反発力に打ち勝っている。
電子は原子核を取り囲む軌道と呼ばれる通路にランダムに存在する。
原子は化学反応では素粒子に分離できないが、核反応により分離できる。
分子とは何か
分子は、2つ以上の原子が集まって電子を共有したり、交換したりすることでできています。
分子内のこれらの原子は、さまざまな種類の結合によって保持されています。
原子の外殻にある電子だけが結合に関与しています。
イオン結合
原子の間で電子が交換される。
電子を放出した原子は正の電荷を帯び、電子を獲得した原子は負の電荷を帯びる。
このように、反対に帯電したイオンが引き合うことをイオン結合と呼びます。
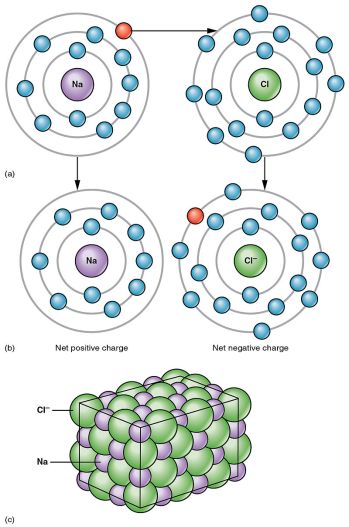 図2 イオン結合の例
図2 イオン結合の例
塩化ナトリウムの例では、Naから1個の電子がClに移動し、Naには正の電荷が残ります。
Clは負に帯電する。
このように、2つのイオンが引き合うことで、塩化ナトリウムはイオン塩とみなされます。
共有結合
共有結合は、2つの原子の間で電子を共有することによって形成されます。
したがって、共有された電子のペアは、関係する両方の原子に属している。
共有結合は単結合だけでなく、二重結合や三重結合のような多重結合を生じさせることもあります。
続きを読む 共有結合とイオン結合の違い
原子と分子の違い
原子のこと。
原子は分子の構成要素です。
対応する元素の化学的性質を示す最小の単体。
分子。
分子は2つ以上の元素からできている。
構成元素の個々の性質は示さない。
コンポーネント
原子。
原子は、陽子、電子、中性子という素粒子から構成されている。
分子。
分子は2つ以上の原子から構成され、同じ元素または異なる元素のどちらでもよい。
安定性
原子のこと。
原子は単独では安定せず、他の原子と化学結合して安定となる。
分子。
分子は単独で安定。
分離
原子のこと。
原子は化学反応によって素粒子に分離することはできない。
核反応によってのみ分離が可能である。
分子。
分子は化学反応で原子に分離できる。
結論
原子と分子は宇宙の創世記の存在です。
先に述べたように、原子は分子を構成している。
しかし、原子の化学的性質は、分子を形成しても保持されないことが多い。
例えば、Naは反応性の高い金属であるが、Clは有毒ガスです。
しかし、食卓塩(NaCl)は金属でも毒性でもありません。
これは、原子が分子になると化学的性質が変化することを示している。
分子は、化学的な手段で構成する原子に分離することができる。
しかし、原子の場合はそうはいかない。
原子は核反応によって素粒子に分離することができる。
分子はそれ自体で存在することができ、安定であることが多い。
しかし、原子の場合はそうではない。
単体で安定に存在できるのは、希ガス配置を持つ原子だけです。
アルゴン、ヘリウム、クリプトンなどがその例です。
その理由は、外殻の電子数が最大に達しているからです。
そのため、電荷を帯びることがありません。
しかし、このような安定性を持たない原子が集まって、電子を共有したり、移動したりして分子を作り、安定性を持つようになるのです。
