共鳴構造とは
分子や多原子イオンの中には、構造中の原子の位置を変えずに、2つ以上のルイス構造を描くことができるものがあります。
この場合、電子分布だけが構造によって異なる。
このような構造を共鳴構造あるいは寄与構造と呼ぶ。
しかし、実際の分子は、それらの可能なルイス構造の中間的な構造を持っています。
共鳴構造を描くには、まず可能性のあるルイス構造を全て描くことから始めます。
ルイス構造が1つしかなければ、共鳴混成構造にはならない。
共鳴を持つ分子の見分け方
共鳴は、ルイス構造が複数の結合を持ち、隣接する原子が少なくとも1つのローンペアを持つ場合にのみ存在する。
共鳴の一般的な形態を下図に示す。
矢印は、ある共鳴構造から別の共鳴構造へ電子が移動していることを示す。

共鳴構造の描き方
ルイス構造
実施例1:CO32-イオン
ステップ1
各原子の価電子の総数を計算する。
炭素原子 = 4
酸素原子 (3*6) = 18
(-2) 電荷 = 2 の場合
** 最後のステップで-2の電荷を考慮する(つまり、この分子には2個の余分な電子がある)。
ステップ2
原子の種類が複数ある場合、電気陰性度や金属性の低い原子を中心原子としておきます。
CO32- イオン  の中心原子は炭素です。
の中心原子は炭素です。
ステップ3
単結合を持つ各原子を、各原子から1個の電子を与えて結合させ、中心原子に結合させます。
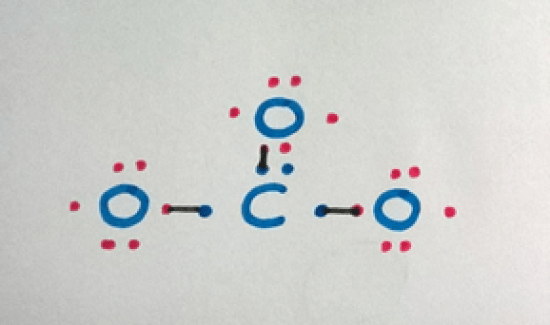
ステップ4
価の電子を数えて、8重奏が完成しているかどうかを確認します。
炭素原子はあと1個、酸素原子はあと1個の電子があれば、八重項が完成します。
ステップ 5
結合がない場合は、すべてのオクテットが埋まるまで結合を追加します。
** 結合していない電子は点として残し、単結合は一本の線(-)、二重結合は二本の線(=)で描きます。
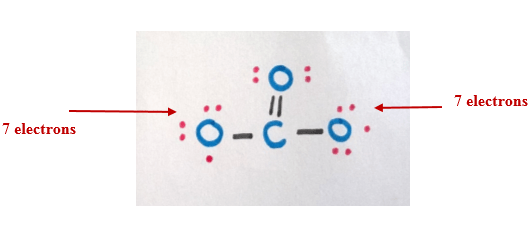
炭素原子と酸素原子の間に1つ結合を加えると、炭素原子と酸素原子の両方で8重結合が完成します。
ステップ6
次に、-2 の電荷(2個の電子を追加すること)を考えます。
他の酸素原子は最外殻に7個の電子しか持っていないので、この2個の電子を分配すればよいのです。
The final structure can be written as follows.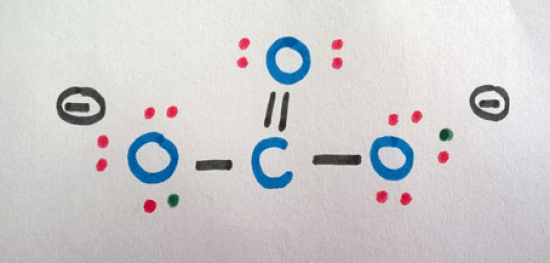
ステップ7
さて、1章で説明したように、考えられる共鳴構造を描いてみましょう。
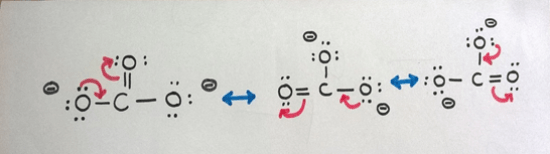
CO32-イオンは、上のように3つの共鳴構造を描くことができます。
もう2つ例を挙げて、共鳴構造の描き方を学びましょう。
例 2: O3分子
上記と同じ手順でルイス構造を得ることができます。
これは次のような構造で、複数の結合と、隣接する原子に1個の孤立電子を持つ。
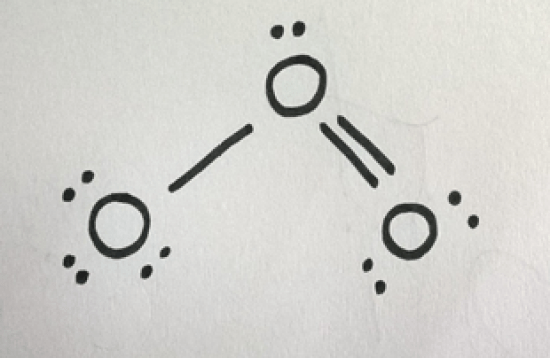
したがって、O3分子の共鳴構造を以下のように描くことができる。
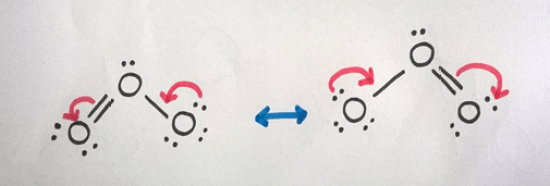
実施例3:カルボン酸
We can obtain the following resonance structures, by following the same steps as mentioned above.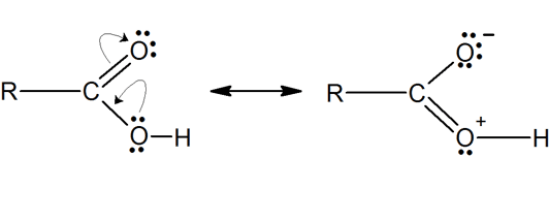
定義
ルイス構造。
分子内の原子の配置を表す簡単な方法で、電子の単独対と原子間の結合を示す。
共振構造の書き方. (n.d.). 2016年11月15日、ここから取得
Ch 1 : 共鳴。
(n.d.)です。
2016年11月15日、ここから取得
ルイスドット構造を描くための簡単なチュートリアル。
(n.d). 2016年11月15日、ここから取得
ビショップ、M.(n.d.)。
レゾナンス。
保存する
