臨界点と三重点の主な相違点
物質の相は、その物質の圧力と温度によって決定される。
したがって、ある物質の相は、温度または圧力のいずれか、あるいは両方を変えることで変化させることができる。
物質の臨界点と三重点は、温度と圧力の重要な組み合わせです。
物質の臨界点は相平衡曲線の端点にあり、三重点は3つの平衡曲線が交わる点です。
物質の臨界点では、気相と液相のみが平衡状態で存在することができる。
しかし、三重点では、物質の3つの相がすべて存在することができる。
これが臨界点と三重点の大きな違いです。
この記事で解説します。
-
臨界点とは?- 定義と解説
-
三重点とは? – 定義と解説
3. What is the difference between Critical Point and Triple Point? – Comparison of Key Features
クリティカルポイントとは
ある物質の臨界点は、その物質の相平衡曲線の終点で発生する。
物質の臨界点は、臨界温度と臨界圧力で定義される。
臨界点の意味を正確に理解するためには、相図について理解しておく必要がある。
相図とは、圧力と温度の組み合わせによって、ある物質の挙動を表した圧力-温度グラフのことである。
相図には、融解線、昇華線、気化線という3つの重要な曲線があります。
融解線は、ある物質の固相と液相が平衡状態で存在できる線です。
昇華線に沿って固相と気相が平衡に存在できる。
液相と気相は気化線に沿って平衡に存在できる。
液相-気相平衡曲線または気化直線の上端を「臨界点」と呼ぶ。
物質の臨界点に対応する温度と圧力を、それぞれ臨界温度、臨界圧力という。
物質の臨界点は、その相図上の特殊な点です。
ある物質に固有の点であり、物質によって異なる。
蒸気(気体)を臨界温度と三重点の中間の温度に保ちながら圧力をかけると、気化線を越えて液体になる。
臨界温度以上では、試料は超臨界状態となり、高圧の気体となる。
つまり、臨界温度以上であれば、圧力を上げるだけでは気体を液体に凝縮させることは不可能である。
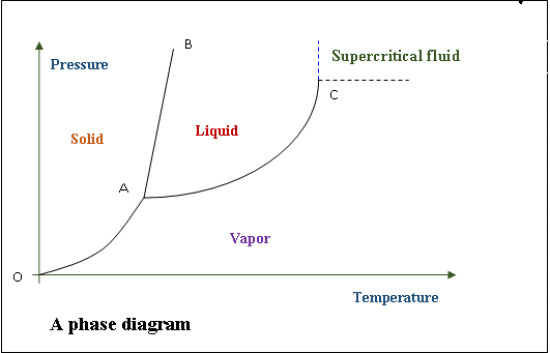
O-A 融合を表す。
A-C 気化線
O-A 昇華線を表す。
A-三重極点
C-臨界点
トリプルポイントとは
熱力学において、ある物質の三重点は、その物質の相図上に存在する重要な点です。
この特別な点は、ある物質の三相(固体、液体、気体)が平衡に共存する圧力と温度と定義できる。
ある物質の三重点は簡単に特定できる。
それは、3本の線がすべて交わる点です。
したがって、物質の三重点では、3つの相がすべて平衡状態で存在することになる。
三重点では、6つのプロセスが同時に起こる。
蒸発、凝縮、融解、凍結、昇華、沈殿です。
この6つの過程の平衡は、系の温度または圧力(あるいはその両方)が変化すると消失する。
三重点は物質によって異なる。
例えば、水の三重点は0.010℃(273.16K)、611.22Paであるが、鉄、銅、鉛の三重点とは異なる。
臨界点と三重点の違い
定義
臨界点。
臨界点:相平衡曲線の終点であり、臨界温度と臨界圧力で定義される。
三重点。
ある物質の3つの相が平衡に共存する圧力と温度と定義できる。
標準温度との関係
臨界点。
臨界温度は通常、標準温度より高い。
(ほとんどの物質でそうである)。
三重点。
三重点:三重点に相当する温度は、通常、標準温度より低い。
(ほとんどの物質で該当)。
標準圧力との関係
臨界点。
臨界圧は一般に標準圧より高い。
三重点。
三重点に相当する圧力は、一般に標準圧力より低い。
物理的意義
臨界点。
臨界点では、液相と気相のみが平衡に共存できる。
三重点。
固相、液相、気相のすべてが平衡に共存できる。
“Phase-diag2” By Matthieumarechal (CC BY-SA 3.0) via Commons Wikimedia
保存する
