主な違い – 立体異性体中心 vs キラル中心
立体異性体の説明には、立体異性中心(stereogenic center)と不斉中心(chiral center)という2つの用語が使われます。
この2つの用語は同じものと思われがちですが、立体発生中心と不斉中心には違いがあります。
すべてのキラル中心は立体異性体中心であるが、すべての立体異性体中心はキラル中心ではない。
立体異性体を生み出すのはこれらの中心の存在であるため、立体原性中心と不斉中心の違いを知ることは重要です。
Stereogenic Centerとは
立体異性体中心とは、そこに結合する原子や基を交換すると、異なる異性体を与える原子のことである。
これらの異性体は、分子の構造は同じであるが、空間的な配置が互いに異なるため、立体異性体と呼ばれる。
つまり、立体異性体は、その3次元的な配置のみが互いに異なる。
立体異性体の中心となる原子は、sp2混成でもsp3混成でもよい。
つまり、二重結合と単結合のどちらかを持っている可能性がある。
アキラルな分子も、時には立体中心を持つことがあります。
したがって、すべてのキラル中心は立体異性体中心です。
しかし、立体異性体中心は本質的にキラル中心ではない。
この良い例がシス-トランス幾何学です。
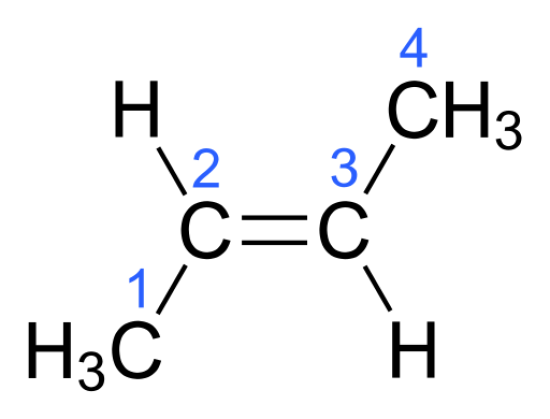 :図1 トランス-2-ブテン
:図1 トランス-2-ブテン
上の図は、trans-2-butene分子。
この分子には不斉中心がない。
しかし、立体異性体の中心は持っています。
なぜなら、炭素原子に結合している2つの基は-Hと-CH3であり、これらの基を交換することで、この分子の立体異性体である新しい分子を得ることができるからです。
この新しい分子がcis-2-buteneです。
キラルセンターとは
不斉中心とは、4つの異なる基と直接結合している炭素原子のことです。
不斉中心を持つ分子は、その鏡像と重ね合わせることができない。
このため、分子と鏡像は異なる2つの分子とみなされる。
炭素原子は常にsp3混成しているので、4つの基とくっつくことができる。
したがって、キラル中心を持つ分子は常に立体異性体を生じさせることができ、キラル中心は常に立体異性体中心です。
1つの分子が複数の不斉中心を持つこともあります。
図2:不斉中心を持つ分子
上の図は、水素原子(H)に結合した炭素原子が、互いに異なる3つの基(X、Y、Z)と共に描かれている。
(X、Y、Z)。
そこでは、炭素原子はキラル中心となっています。
それはsp3混成であり、4つの異なる基と結合している。
その鏡像は、分子と非重畳的です。
Stereogenic Center vs Chiral Center (立体配向中心 vs キラル中心)
立体異性体と不斉中心の類似性
-
立体異性体は、立体異性中心またはキラル中心が存在することによって生じる。
-
キラル中心は常に立体異性体中心であるが、立体異性体中心は全てキラル中心ではない。
立体異性体とキラル中心の違い
定義
立体異性体中心。
立体異性体の中心は、それに結合する原子または基を交換すると、異なる異性体を与える任意の原子です。
キラル中心。
不斉中心とは、4つの異なる基と直接結合している原子のことである。
ハイブリッド化
立体中心。
炭素原子がsp2またはsp3混成している立体中心。
キラル中心。
キラル中心では、炭素原子は常にsp3混成している。
グループ数
ステレオジェニックセンター。
立体中心は、3つまたは4つの基が結合していることがあります。
キラル中心。
キラルセンターは常に4つの基を持つ。
ボンド
立体派の中心。
立体中心:単結合と二重結合のいずれかを持つことができる。
キラル中心。
キラル中心は単結合のみを持つ。
キラリティ
立体異性体中心。
立体異性中心は、キラル分子とアキラル分子のいずれにも存在する。
キラル中心。
キラル中心は、キラル分子のみに存在する。
グループ交換
立体異性体の中心。
立体異性体を持つ分子の中には、結合している基を交換することで立体異性体を与えるものがあります。
キラル中心。
キラル中心:キラル中心を持つ分子は、結合した基を交換しても差が出ない。
結論
すべてのキラル中心は立体異性体中心であるが、すべての立体異性体中心はキラル中心ではない。
立体異性体と不斉中心の違いを識別するために使用できる多くの明確な特徴があります。
