主な相違点 – 生成熱 vs 反応熱
エンタルピーは、化学反応の進行中に吸収または発生する熱エネルギーのことです。
エンタルピーは記号 H で表され、H はエネルギー量を示します。
エンタルピーの変化は△Hと与えられ、△という記号はエンタルピーの変化を示す。
生成熱と反応熱はエンタルピーの2つの形式です。
生成熱と反応熱の主な違いは、生成熱が化合物の生成時に吸収または放出されるエネルギー量であるのに対し、反応熱はあらゆる化学反応時に吸収または放出されるエネルギー量であることである。
創造熱とは
The heat of formation is the change of enthalpy when one mole of a compound is formed from its constituent elements. This is called standard heat of formation when it is given for the formation of substances at their standard states. The standard pressure is 105 Pa (1 bar), as recommended by IUPAC. However, there is no defined standard temperature. Hence, the heat of formation is given for a constant pressure. The symbol for the standard heat of formation is ΔHf°. It can be calculated using the following equation.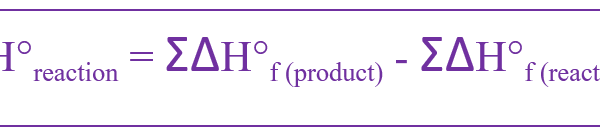
この式によると、標準生成熱は生成物の標準生成エンタルピーと反応物の標準生成エンタルピーの和の差に等しい。
反応熱とは
反応熱とは、化学反応時に付加または放出されるべきエネルギーの正味量です。
言い換えると、一定の圧力で起こる化学反応におけるエンタルピーの変化です。
熱は、すべての反応物を一定の温度に保つために加えられるか、放出される。
熱は物質1モルあたりで測定される。
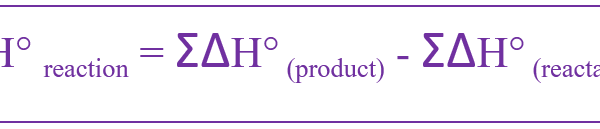
反応熱は以下のように与えられる。
これを標準状態について定義すると、標準反応エンタルピーと呼ばれる。
標準状態とは、1バールの圧力と適切な温度における純粋な物質の状態です。
反応熱の値が正の値であれば、その反応は吸熱性(外から熱を吸収する)であることを示す。
しかし、反応熱の値が負の値であれば、その反応は発熱性である(熱を放出する)ことを示す。
生成熱と反応熱の違い
定義
生成熱。
生成熱とは、構成元素から1モルの化合物が生成されるときのエンタルピーの変化です。
反応熱。
反応熱は、化学反応中に付加または放出されるべきエネルギーの正味量です。
コンセプト
生成熱。
生成熱:化合物が生成されるときのエンタルピーの変化を表す。
反応熱。
反応熱は、化学反応中に系に加えられた、または系から除去された熱の量を示す。
結論
生成熱と反応熱は、化学反応について定義された 2 種類のエンタルピーです。
生成熱と反応熱の主な違いは、生成熱が化合物の生成時に吸収または放出されるエネルギー量であるのに対して、反応熱はあらゆる化学反応時に吸収または放出されるエネルギー量であることです。
