拡散と噴出の主な違いは、拡散が濃度勾配を通る粒子の移動であるのに対し、噴出は小さな穴を通る気体分子の移動であることです。
さらに、拡散は固体、液体、気体の分子の動きを表し、気体だけが噴出を起こします。
拡散と噴出は、異なる分子がある場所から別の場所に移動するために使用される2つの方法です。
さらに、グラハムの法則は、拡散または噴出の速度と気体のモル質量との関係を記述している。
拡散とは
拡散とは、濃度勾配を通過する分子の移動の一種である。
固体、液体、気体など3種類の分子すべてで発生する可能性がある。
拡散の主な重要性は、障壁のない空間で分子同士が混ざり合うことを可能にすることである。
しかし、それは主に分子の濃度勾配によって起こる。
しかし、分子の大きさと運動エネルギーに依存する。
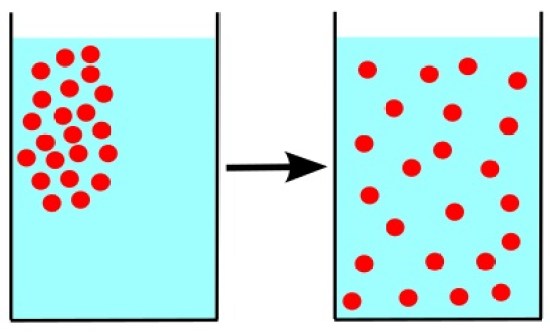 図1: 拡散
図1: 拡散
気体を考えるとき、拡散は分子の熱的ランダム運動です。
ここで、気体分子間に起こる衝突によって、気体の分子エネルギーが放出される。
したがって、拡散の効率を低下させる大きな要因のひとつとなる。
エフュージョンとは
気体分子の運動の一種である。
ピンホールから真空中に気体分子を逃がすことで発生する。
簡単に言うと、気体分子が小さな穴を通って移動する能力のことである。
ここで、開口部は分子の平均自由行程より小さくなければならない。
図2:エフュージョン
さらに、開口部の両側で気体分子の濃度勾配が生じると、開口部を挟んで圧力勾配が発生する。
この圧力勾配が、気体分子を高濃度から低濃度へと移動させる大きな駆動力となって、開口部を通過させるのです。
拡散と蒸発の類似性
- 拡散と拡散は、異なる種類の分子が1つの場所から別の場所に移動するために使用される2つのメカニズムです。
- どちらの方法も、濃度勾配を通して行われる。
- また、分子の流れは一定であり、ランダムです。
- また、両者とも分子の移動にエネルギーを使わない。
拡散と拡散の違い
定義
拡散とは、粒子(原子、イオン、または分子)が高濃度領域から低濃度領域へ純受動的に移動することである。
気体粒子が小さな穴を通って移動することを「噴出」という。
これが拡散と噴出の主な違いです。
分子の種類
拡散と噴出のもう一つの大きな違いは、拡散は固体、液体、気体の分子で起こるのに対し、噴出は気体分子だけで起こるということです。
ムーブメントの種類
また、分子が空間中を自由に移動するのが拡散、小さな穴を通って移動するのが噴出です。
原動力
さらに、拡散では濃度勾配が駆動力となり、噴出では気体の濃度勾配が圧力勾配を発生させる。
衝突
もう一つ、拡散と噴出の違いは、拡散では分子同士の衝突が起こるのに対し、噴出では分子同士の衝突がないことです。
効率性
また、拡散は効率が悪く、噴出は圧力差の関係で効率が良い。
結論
拡散とは、濃度勾配を通過して分子が移動することである。
固体、液体、気体の分子がこの方式で移動する。
一方、気体分子が濃度勾配を通り抜けること、特に小さな穴を通って移動することを噴出という。
圧力勾配を伴うため、非常に効率の良い方法です。
したがって、拡散と噴出の主な違いは、気体をろ過するバリアです。
