主な相違点 – 価数 vs 価数
原子核に存在する電子に関連して、価数と原子価が説明されます。
電子は原子核の周りの殻や軌道に存在することが知られています。
したがって、この電子と原子核の間の引力の強さに応じて、原子から電子が失われることがあります。
原子の一番外側の軌道にある電子に関係するのが、価数と価電子です。
価数と価数の主な違いは、価数は原子が他の原子と結合する能力であるのに対し、価数は原子が自身を安定させるために失うか得ることができる電子の最大数であることである。
価とは
原子価とは、ある原子が他の原子と結合する能力のことです。
言い換えれば、特定の原子の結合力の度合いです。
原子の価数は、原子の一番外側の軌道に存在する電子の数に関係します。
これらの電子は価電子と呼ばれる。
他の原子と結合するためには、特定の原子は、失うか、得るか、あるいは対になることができる価電子を持つ必要があります。
これは、2つの原子の結合には、イオン結合と共有結合があり、いずれも原子が電子を失うか、獲得するか、あるいは共有することになるからです。
原子の価数は、その原子に結合できる1価の原子の数、または原子が持つことのできる単結合の数として与えることができる。
これは、原子に結合できる水素原子(H)の数としても定義できます。
これは、水素原子が1価であり、他の原子と結合しやすいためです。
原子の中には、他の原子と異なる比率で結合できるものがあります。
そのため、1つの原子が複数の価数を持つことがあります。
原子価=結合力の強さ
= 結合できる1価の原子の数
= 結合できるH原子の数。
例えば、水素原子は1つの水素原子としかくっつかないし、他の1価の原子ともくっつかない。
したがって、水素の原子価は1です。
水素の電子配置:1s1
Orbital Diagram of Hydrogen: 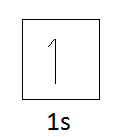
したがって、水素は電子を受け入れるスペースが1つしかなく、そうでない場合は電子を1つだけ失うことができます。
そのため、1価の原子としか結合できません。
ですから、水素の原子価は1です。
次に、窒素を考えてみましょう。
窒素の原子番号は7です。
窒素の電子配置:1s22s22p3
Orbital diagram of Nitrogen: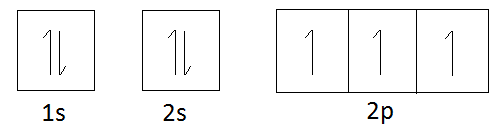
窒素の軌道図によると、窒素は電子が入るスペースが3つあります。
これは、不対電子が3個あり、他の原子から電子を分けてもらうことで対になることができるためです。
つまり、窒素は1個、2個、3個の水素原子に結合することができます。
また、窒素は1個、2個、または3個の電子を失うことができます。
したがって、原子は複数の価数を持つことができます。
さらに、原子の価数は、プラス(+)かマイナス(-)のマークで表されます。
これは、その電子の損失や獲得を示すためです。
上記の例では、水素の原子価は+1または-1です。
窒素の価数は、-3、-2、-1、+2、+3です。
Valencyとは
原子核が安定するために失うことのできる電子の最大数のことです。
価電子の数によって原子の価数が決まるため、この用語は主に価電子に関係する。
例えば、炭素原子を考えてみましょう。
炭素の電子配置 1s22s22p2
Orbital diagram of Carbon: 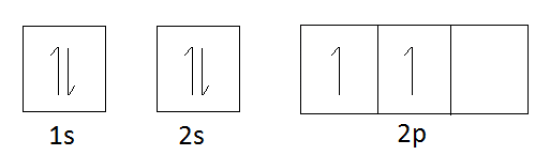
炭素の軌道図から、8重則に従うと4個の電子を得る必要があります。
(オクテット則とは、原子の最外周の軌道に8個の電子がある状態が最も安定であることを示す)。
4個の電子を獲得すると、n=2軌道の電子数(2sと2p)は合計で8個となる。
したがって、炭素の原子価は4です。
Valence と Valency の類似点
原子の価数は、その原子の価数の 1 つに等しくなります。
これは、原子が失う、得る、または共有できる電子の最大数によって、その原子の結合強度が決まるからです。
したがって、定義は異なるが、価数と原子価の両方の値が同じになることがあります。
ValenceとValencyの違い
定義
原子価。
原子が他の原子と結合する能力。
価数。
原子自身が安定するために失うか得ることができる電子の最大数のこと。
代表的なもの
価数。
価数は整数で表し、数値の前に+または-の記号を付ける。
価数。
価数は+または-記号を付けずに数値のみで表す。
値
原子価。
原子の原子価は複数の値を持つことができる。
価数。
原子の原子価は1つだけです。
結論
原子の価数と原子価は同じ概念であっても、その定義や表現に若干の違いがあります。
原子価は原子が持つことのできる結合の数を示し、価数は原子が持つことのできる結合の最大数を示す。
