主な相違点 – 蒸気圧と沸点
液体や固体の相変化を表す用語として、気化と沸騰があります。
気化は、液体や固体がその蒸気に相変化することです。
沸騰は、液体が蒸気に相変化することである。
気化は閉鎖系の蒸気圧を発生させる。
沸点とは、液体が気化する温度です。
この2つの用語は互いに関連しているが、両者の間には違いがあります。
蒸気圧と沸点の主な違いは、蒸気圧が圧力の測定であるのに対し、沸点は温度の測定であることである。
蒸気圧とは?
蒸気圧は、蒸気が発揮する力と定義することができる。
蒸気が蒸気圧を発揮するためには、以下の条件を満たす必要がある。
- 蒸気は液相または固相と平衡状態でなければならない。
- 蒸気は温度が一定でなければならない。
- 蒸気もその凝縮体も閉じた系に存在しなければならない。
蒸気圧は、分子が液体や固体から逃げ出そうとする欲求に関係する。
従って、常温で蒸気圧が高い物質は揮発性であると考えられる。
温度が一定である限り、蒸気圧も一定です。
しかし、ひとたび温度を上げると、液体分子のキネシス(運動エネルギー)が増大し、液体からどんどん分子が放出される。
その結果、液体分子から蒸気への移行が大きくなる。
したがって、蒸気圧も高くなる。
ある温度で蒸気圧は液体や固体にかかる外圧と等しくなる。
この温度を液体の沸点と呼ぶ。
図1: 蒸気圧
沸点とは?
沸点とは、液体が沸騰する温度のことです。
つまり、液体の蒸気圧が周囲の環境からかかる外圧と等しくなる温度です。
液体の沸点は、大気圧によって変化する。
従って、ある液体の沸点の値は常に一定ではない。
大気圧は標高によって変化する。
例えば、大気圧が1気圧のとき、水は通常1000℃で沸騰する。
しかし、標高が高いところでは、水は低い温度で沸騰する。
これは、液体が沸騰するためには、蒸気圧が大気圧と同じでなければならないからだ。
高度が高いほど圧力が低くなるため、熱エネルギー(温度)が低くても上記の条件を満たせばよいことになる。
沸点以下の温度でも、液体の分子は蒸発という過程によって蒸気になる。
蒸発とは、液体の表面にある液体分子が逃げ出すことである。
これらの分子は、液体中の他の分子とゆるく結合しているだけなので、簡単に他の分子から離れ、蒸気として液体から抜け出すことができる。
しかし、沸騰の場合は、液体中のどこにでもある分子が液体から抜け出すことができるのです。
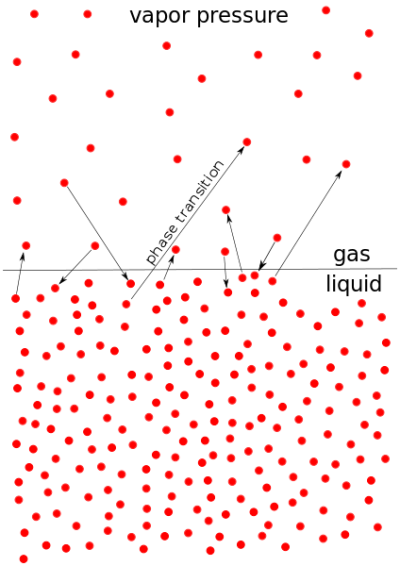 図02: やかんの口から出る水蒸気
図02: やかんの口から出る水蒸気
蒸気圧と沸点の違い
定義
蒸気圧。
蒸気圧とは、密閉された容器や空間の中で、液体や固体物質が放出する蒸気によって及ぼされる力です。
沸点:沸点は、蒸気圧が液体にかかる外圧と等しくなる温度です。
特定条件
蒸気圧。
蒸気圧は、温度が一定の閉鎖系で定義される。
沸点:沸点は、圧力が一定である系で定義される。
物理状態
蒸気圧。
蒸気圧は固相と液相の両方に関係する。
沸点:沸点は液相にのみ関係する。
バリエーション
蒸気圧。
蒸気圧は温度によって変化する。
沸点:沸点は大気圧によって変化する。
結論
蒸気圧と沸点は物理化学でよく使われる関連用語です。
蒸気圧は沸点と関係があるが、両者は異なる性質を持っています。
蒸気圧と沸点の主な違いは、蒸気圧が圧力の測定であるのに対し、沸点は温度の測定である点です。
