主な違い – 異性体 vs エピマー
異性体は、近縁の分子間の違いを説明するものです。
異性体は、構造異性体と立体異性体の2つに大別される。
構造異性論は、同じ化学式で異なる構造を示す。
立体異性論は、同じ分子式を持つ分子の空間的な配置が異なることを示す。
立体異性体には、アノマーとエピマーがあります。
アノマーとエピマーという用語は、糖鎖の構造を説明するために使われます。
これらは、有機化合物間の違いを識別するために用いられる。
アノマーとエピマーの主な違いは、アノマーはアノマー炭素で構造が互いに異なるのに対し、エピマーは構造中に存在するキラル炭素のいずれかで互いに異なるという点です。
アノマーとは
アノマーとは、アノマー炭素の配置の違いによって生じる立体異性体のことである。
アノマー炭素とは、糖分子の非環状体において、アルデヒド基またはケトン基を持つ炭素原子のことである。
糖分子は、非環状になった糖分子の一端にアルデヒド基またはケトン基、もう一端にアルコール基が結合した構造をしている。
この両端の基は、より安定になるように互いに反応し、環状の糖分子を形成することができる。
この環状糖鎖では、アノマー炭素に-OH基が結合している。
この-OH基の位置は、一方のアノマー分子と反対方向です。
一方のアノマーが他方のアノマーに変化することをアノマー化という。
これは可逆的なプロセスです。
しかし、どちらのアノマーも環状構造を持つ安定な分子です。
この2つのアノマーは、α(アルファ)アノマーまたはβ(ベータ)アノマーと名付けられます。
上の図に示すように、αアノマーのアノマー炭素に結合している-OH基は、グルコースのβアノマーのそれと反対方向です。
アノマー炭素は緑色で示されている。
エピマーズとは
エピマーとは、不斉炭素が1つだけ異なる立体異性体の一種である。
エピマーはジアステレオマーの一種である。
不斉炭素は複数存在するが、エピマーは1つの炭素中心のみが互いに異なる。
エピマーは互いに鏡像ではありません。
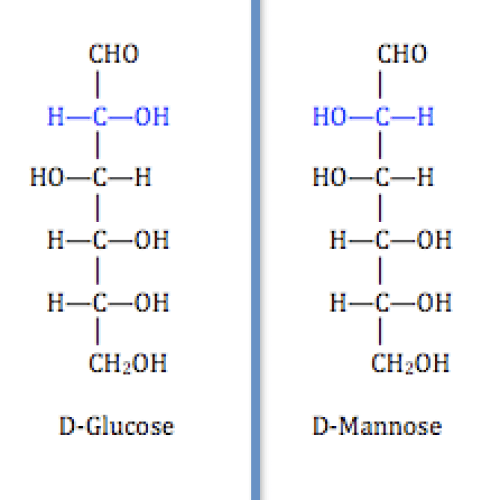 図2: エピマー
図2: エピマー
上の図に示すように、D-グルコースとD-マンノースは互いにエピマーです。
青く塗られた部分が異性化した場所です。
ここで、-OH基はD-グルコースでは右側にあるのに対し、D-マンノースでは左側に向いている。
その他の炭素原子も、それらの分子では不斉炭素であるが、互いに同一です。
したがって、異性化が起こった炭素原子をエピメリックカーボンと呼ぶ。
アノマーとエピマーの類似性
- アノマーとエピマーは立体異性体です。
- 両者とも炭素原子1個の違いにより形成される。
- 両者とも糖類に多く含まれる。
- 異性体は、炭素に結合している1つの-OH基の位置の違いにより発生します。
アノマーとエピマーの違い
定義
アノマー。
アノマーは、アノマー炭素の配置の違いによって生じる立体異性体です。
エピマー。
エピマーとは、1つの不斉炭素だけが異なる立体異性体の一種。
異性化する炭素
アノマー。
アノマー:アノマーの炭素で異性化する。
エピマー。
エピマーのエピメリックカーボンで異性化する。
糖分子の構造
アノマー アノマーは環状分子です。
エピマー。
エピマーは非環状分子でも環状分子でもよい。
結論
アノマーとエピマーは立体異性体です。
ある形のアノマーは、反対の形のアノマーに変換することができます。
それをアノマー化という。
また、エピマーができることをエピメリゼーションという。
アノマーもエピマーも炭素の中心が1つだけ異なる分子であるが、両者は異なる用語です。
アノマーとエピマーの主な違いは、アノマーはその構造においてアノマー炭素で互いに異なるのに対し、エピマーはその構造中に存在するキラル炭素のいずれかで互いに異なることである。
