主な違い – 電子親和力 vs 電離エネルギー
電子は原子を構成する素粒子です。
電子の振る舞いを説明する化学的な概念は数多く存在します。
電子親和力とイオン化エネルギーは、そのような化学の概念の一つです。
電子親和力は、中性の原子や分子が電子を獲得するときに放出されるエネルギー量です。
電子親和力は、意味を考えると電子増加エンタルピーとも言えますが、電子増加エンタルピーは原子が電子を得たときに周囲から吸収されるエネルギー量を表すので、両者は異なる用語です。
一方、イオン化エネルギーは、原子から電子を取り除くのに必要なエネルギー量である。
電子親和力とイオン化エネルギーの大きな違いは、電子親和力が原子が電子を得たときに放出するエネルギー量であるのに対し、イオン化エネルギーは原子から電子を取り除くために必要なエネルギー量であることです。
電子親和力とは
電子親和力とは、中性原子や分子(気相)が外部から電子を獲得する際に放出されるエネルギー量のことです。
この電子の付加により、負に帯電した化学種が形成される。
これを記号で表すと次のようになる。
X + e- → X- + エネルギー
中性原子や分子に電子が加わると、エネルギーが放出される。
これを発熱反応といいます。
この反応により、マイナスイオンが発生します。
しかし、このマイナスイオンに別の電子を加えようとすると、その反応を進めるためにエネルギーを与える必要があります。
これは、入ってきた電子が他の電子にはじかれるからです。
このような現象を吸熱反応といいます。
したがって、同じ種の第1電子親和力は負の値、第2電子親和力は正の値となる。
第1電子親和力 X(g) + e- → X(g)- となる。
第二電子親和力 X (g)- + e- → X (g)-2
電子親和力は周期表で周期的な変化を示している。
これは、入ってきた電子が原子の一番外側の軌道に付加されるからです。
周期表の元素は、原子番号の昇順に従って配列されている。
原子番号が大きくなると、最外周の軌道にある電子の数が増える。
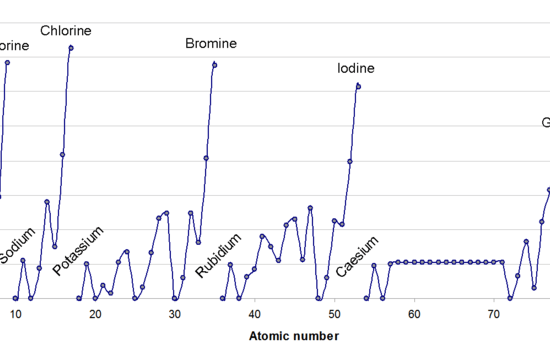 : 図1: 周期表に沿った電子親和力の変化
: 図1: 周期表に沿った電子親和力の変化
一般に、電子の数は周期に沿って増加するため、電子親和力は周期に沿って左から右に増加するはずであり、新しい電子を追加することは困難です。
しかし、実験的に分析すると、電子親和力は徐々に増加するパターンではなく、ジグザグに変化する。
電離エネルギーとは
イオン化エネルギーとは、気体原子が最外周の軌道から電子を1個取り出すために必要なエネルギー量のことです。
電子を取り去った原子は正の電荷を帯び、正電荷のイオンとなるため、イオン化エネルギーと呼ばれます。
ある元素の原子は他の元素の原子と異なるため、化学元素はそれぞれ固有のイオン化エネルギー値を持っています。
例えば、第1イオン化エネルギーは、原子が電子を1個取り除くのに必要なエネルギー量を、第2イオン化エネルギーは、原子が電子を1個取り除くのに必要なエネルギー量を、それぞれ表しています。
第一イオン化エネルギー
第一イオン化エネルギーとは、気体である中性原子が最外殻の電子を取り出すのに必要なエネルギー量のことです。
この最外殻電子は、原子の最外周の軌道に位置している。
従って、この電子は原子の他の電子の中で最も高いエネルギーを持っています。
したがって、第1イオン化エネルギーは、原子から最もエネルギーの高い電子を放出するのに必要なエネルギーとなります。
この反応は、基本的に吸熱反応です。
中性荷電原子は、その元素が構成すべき本来の電子数のみで構成されているため、この概念は中性荷電原子に関連しています。
ただし、そのために必要なエネルギーは元素の種類によって異なる。
原子の中ですべての電子が対になっている場合は、より高いエネルギーが必要となる。
不対電子がある場合は、より低いエネルギーが必要となる。
しかし、その値は他のいくつかの事実にも依存する。
例えば、原子半径が大きければ、一番外側の電子は原子核から離れているため、必要なエネルギーは小さくなります。
この電子と原子核の間に働く引力は小さい。
そのため、簡単に除去することができる。
しかし、原子半径が小さいと、電子は原子核に強く引きつけられてしまい、電子を原子から取り除くことが難しくなります。
第 2 電離エネルギー
二次イオン化エネルギーとは、正電荷を帯びた気体原子から一番外側の電子を取り除くのに必要なエネルギー量と定義することができる。
中性に帯電した原子から電子を取り除くと、正の電荷を帯びることになります。
これは、原子核の正の電荷を中和するための電子が足りないからです。
この正電荷の原子から別の電子を取り出すには、非常に大きなエネルギーが必要です。
このエネルギー量を第2イオン化エネルギーと呼びます。
これは、中性原子から電子を1個取り除いても、残りの電子が原子核に強く引きつけられてしまうためです。
電子親和力と電離エネルギーの類似性
- どちらもエネルギーに関する用語です。
- 電子親和力とイオン化エネルギーの値は、いずれも対象となる原子の電子配置に依存する。
- 両者とも周期表でパターンを示している。
電子親和力とイオン化エネルギーの違い
定義
電子親和力。
中性原子または分子(気体相)が外部から電子を獲得する際に放出されるエネルギー量。
イオン化エネルギー:気体原子が最外周の軌道から電子を取り出すために必要なエネルギー量。
エネルギー
電子の親和性。
電子親和力:エネルギーを周囲に放出することを表す。
電離エネルギー:電離エネルギーは、外部からのエネルギー吸収を表す。
電子のエネルギー
電子の親和性。
電子親和力:電子を獲得する際に用いる。
イオン化エネルギー:イオン化エネルギーは、電子を取り除くことを表現するのに使われる。
結論
電子親和力とイオン化エネルギーは、電子と原子の振る舞いを定量的に表現するための化学用語です。
電子親和力とイオン化エネルギーの主な違いは、電子親和力が原子が電子を獲得するときに放出するエネルギー量であるのに対し、イオン化エネルギーは原子から電子を取り除くのに必要なエネルギー量であることです。
