イムノブロットとウェスタンブロットの違いについてですが、分子生物学や免疫遺伝学において、試料中に存在する特定のタンパク質を検出する手法であるウェスタンブロットに対して、イムノブロットという名称の方がより正確な名称です。
ウェスタンブロットのプロセスには抗体が関与しているため、より正確にはイムノブロットと名付けることができる。
したがって、イムノブロットとウェスタンブロットには、原理、方法、用途のいずれにおいても大きな違いはない。
基本的に、ウェスタンブロットでは、タンパク質はゲル電気泳動によって変性し、サイズ分離される。
その後、分離されたタンパク質バンドは、ニトロセルロースやPVDFなどの担体膜に転写され、ブロッティングとして知られるプロセスとなる。
最終的には、蛍光標識、放射性標識、レポーター酵素を結合させた抗体が、膜上の特定のタンパク質の認識に関与する。
キーワード
タンパク質検出、イムノブロット、一次抗体、二次抗体、ウェスタンブロット
イムノブロットとは
イムノブロットとは、分子生物学や免疫遺伝学において、試料中の特定のタンパク質を検出するために最も頻繁に用いられる手法です。
一般に、タンパク質の検出に抗血清を用いることから、「イムノブロット」と呼ばれています。
図1:イムノブロット法
イムノブロット法は、スイスのバーゼルにあるFriedrich Miescher研究所のHarry Towbinの研究室が開発したものです。
ここでは、イムノブロットの原理として、タンパク質の均等な負荷、分子量によるタンパク質の分離、適切な膜へのタンパク質の電気泳動による移動、抗体のプロービングを挙げている。
イムノブロットの方法
タンパク質の等量投入
通常、イムノブロットでは、各サンプルごとに等しい濃度のタンパク質を搭載することが重要です。
基本的に各サンプルは、タンパク質抽出液、細胞溶解バッファー、サンプルバッファーの3つで構成されています。
ここで、細胞溶解バッファーとは、タンパク質抽出液を目的のタンパク質濃度に正規化するために重要です。
さらに、サンプルバッファー(Laemmli buffer)は、イムノブロットのサンプル調製に特有のものです。
これは、SDS-PAGEで機能する試薬を含んでいる。
また、Tris-HCl pH 6.80 グリセロール、SDS、β-メルカプトエタノール、ブロモフェノールブルーが含まれている。
Tris-HCl pH 6.80は、不連続バッファーシステムとのコンジュゲーションで機能します。
また、グリセロールはロード時にサンプルに密度を加えます。
さらに、SDSは強力なイオン性洗浄剤であり、質量比に対して等しい陰イオンで変性タンパク質を被覆する。
そのため、タンパク質の電荷、サイズ、形状をマスクし、分子量の関数としてタンパク質の分離を可能にする。
一方、β-メルカプトエタノールはジスルフィド結合を減少させるため、タンパク質の形状をある程度保持することができる。
さらに、ブロモフェノールブルーは、ゲル電気泳動時の染料フロントの役割を果たす。
分子量によるタンパク質の分離
SDS-PAGEでは、洗剤と不連続なバッファーシステムにより、試料の分子量による分離が可能である。
一般に、試料はゲルにロードされる前に熱変性され、単量体分子量による分離が保証される。
また、SDS-PAGEにおける洗浄剤はSDSです。
図2:SDS-PAGEの様子
さらに、不連続バッファシステムには、ランニングバッファと電極バッファの2つのバッファがあります。
電気泳動転写
通常、ブロッティングの方法は、タンパク質を異なる膜に電気泳動で移動させるものが多い。
しかし、その原理は、負電荷を帯びた試料が陽極に向かって移動するというもので、似ている。
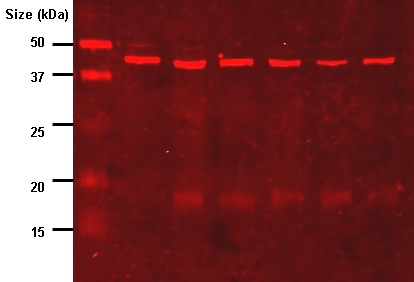 図3:電気泳動転写
図3:電気泳動転写
このプロセスでは、PVDF膜が登場するまで、ニトロセルロースが膜として金字塔を打ち立てていた。
重要なことは、これらの膜は前者に比べてタンパク質結合能が高いということである。
抗体プロービング
プロービングと解析には、最終的に2種類の抗体が使用されます。
一次抗体と二次抗体です。
さて、タンパク質は膜上に存在する。
一次抗体は、膜上のタンパク質の特定部位に直接結合する。
一方、二次抗体は、一次抗体によって間接的に特定のタンパク質に結合する。
重要なことは、ブロッキングという手順で、抗体プロービングの前に膜上に残っている表面領域をコーティングすることである。
したがって、これによりバックグラウンドが減少し、偽陽性が排除される。
また、ブロッキングバッファーには、カゼインやウシ血清アルブミン(BSA)が含まれていますが、いずれもサンプルタンパク質に対する親和性は低く、ブロッキングバッファーは、サンプルタンパク質に対する親和性を低下させます。
さらに、2種類の抗体でメンブレンをインキュベートした後の洗浄工程も、バックグラウンド低減のために重要です。
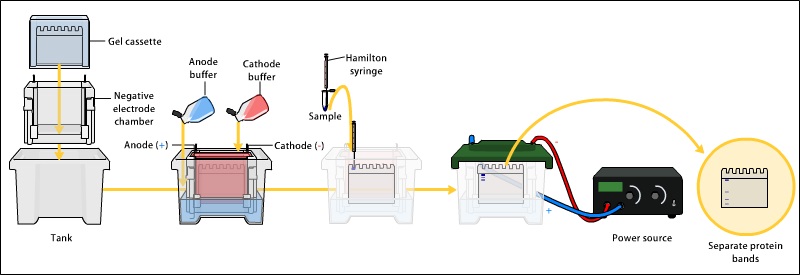 図4: 抗体のプロービング
図4: 抗体のプロービング
さらに、二次抗体は通常、分析に特異的な成分とコンジュゲートしている。
この成分は、放射性同位体、蛍光体、あるいは西洋わさびペルオキシダーゼ(HRP)やアルカリホスファターゼ(AP)のようなレポーター酵素のいずれかであることが一般的です。
重要なことは、化学発光法における分析で酵素を使用することにより、比色分析を通じて膜上の結合した抗体を検出することができるということである。
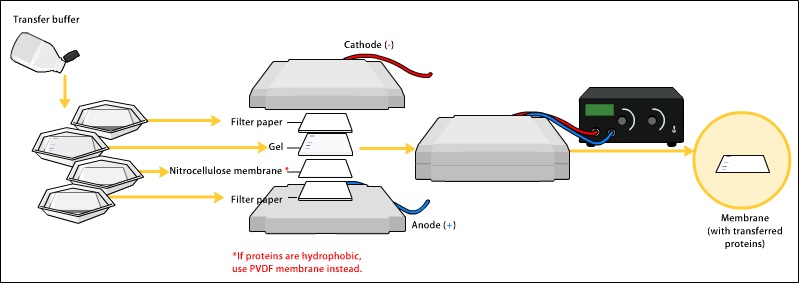 図5:化学発光法による検出
図5:化学発光法による検出
最後に、膜上のバンドを可視化することで、使用した一次抗体に対する特異的なタンパク質の存在を確認することができる。
アプリケーション
生化学において、イムノブロットは単一タンパク質やタンパク質修飾の定性分析に広く重要です。
また、バンドのサイズと色の強さによって、半定量的な分析が可能である。
そのため、クローニング後のタンパク質産生を確認する際にも重要です。
臨床的には、血清や尿中の抗HIV抗体の検出において、イムノブロットは重要な役割を担っている。
通常、ELISA検査では偽陽性を示すことがあるため、HIVの診断を確定することが重要です。
また、変異型クロイツフェルト・ヤコブ病、牛海綿状脳症または狂牛病、ライム病などの検出にも重要です。
ウェスタンブロットとは
ウェスタンブロット」とは、試料中の特定のタンパク質を検出するイムノブロットの別称です。
しかし、「ウェスタンブロット」という言葉は、1981年にW・ニール・バーネットがDNAの同名サザンブロットにちなんで作った造語です。
一方、サザンブロットは、イギリスの生物学者エドウィン・サザンによって開発されたもので、膜ブロット上で特定のDNA配列を検出するものです。
また、「ノーザンブロット」は、1977年にスタンフォード大学のJames Alwine、David Kemp、George StarkがGerhard Heinrichの貢献により開発したRNAを検出する技術です。
イムノブロットとウェスタンブロットの違い
- イムノブロットとウェスタンブロットには大きな違いはありません。しかし、試料中のタンパク質を検出するために抗体を使用することから、イムノブロットの方がより正しい技術名です。
結論
イムノブロットとは、分子生物学において、抗体を用いて試料中の特定のタンパク質を検出する手法です。
このように、抗体を用いて検出することから、より正しい名称はイムノブロットです。
しかし、その逆の手法であるサザンブロットのように、ブロット中の特定のDNA配列を検出するために、「ウェスタンブロット」とも呼ばれています。
イムノブロットでは、変性したタンパク質をゲル上でサイズ分離し、その断片を膜に移します。
最後に、標識抗体は膜上の特定のタンパク質に結合する。
従って、イムノブロットとウェスタンブロットには、原理、方法、用途のいずれにおいても大きな違いはない。
