主な相違点 – 水酸基と水酸化物
水酸基と水酸化物という2つの用語は、響きが似ていて化学構造も似ていますが、いくつかの点で互いに異なっています。
水酸基という用語は、共有結合で分子に結合している原子群(酸素原子と水素原子が1つずつ)に与えられる名前です。
水酸化物とは、酸素原子1個と水素原子1個からなる陰イオンを指します。
IUPACの規則ではhydroxylはOHラジカルであり、-OH基にはhydroxyという名称が与えられている。
しかし、一般的な用法では、-OH官能基を指してヒドロキシル基という用語を使います。
水酸基と水酸化物の主な違いは、水酸化物が陰イオンとして自由な形で存在できるのに対し、水酸基は自由な形では存在できないことです。
ヒドロキシルとは
水酸基は、分子に結合している原子団です。
したがって、常に分子の一部として存在する。
水酸基は不安定なラジカルであり、ラジカルは他の分子と反応して安定化するため、自由な形の水酸基は存在しない。
水酸基は有機分子にも無機分子にも含まれている。
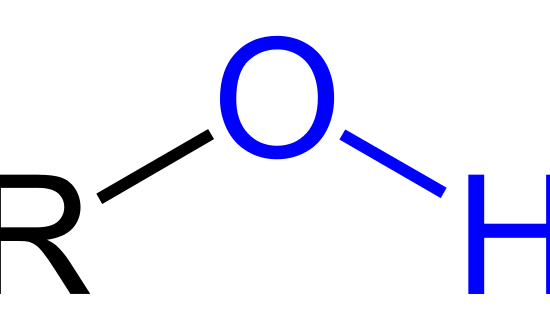 図1:水酸基は青色で表示。
図1:水酸基は青色で表示。
「Rは残りの分子を示す。
水酸基は常に共有結合を形成している。
したがって、水酸基は共有結合を持つ化合物にしか存在しない。
水酸基を含む有機化合物の代表的なものは、アルコールとカルボン酸です。
ここで、水酸基はその分子の官能基として働いている。
分子の残りの部分の化学的および物理的性質は、そこに付いている水酸基によって決定される。
水酸基は、無機化合物にも存在する。
例えば、硫酸やリン酸などの一部の酸は、水酸基で構成されている。
水酸基は、化合物の化学的性質にも寄与している。
水酸基は強い水素結合を形成することができる。
水酸化物とは
水酸化物は、無機アニオンの一種です。
酸素原子1個と水素原子1個が共有結合で結ばれています。
この陰イオンは-1価の電荷を帯びています。
この電荷は、酸素原子に余分な電子が存在するために酸素原子上にあります。
水酸化物アニオンは安定な化合物です。
水酸化物アニオンの化学記号はOH-です。
図2:水酸化物アニオン
水酸化物は、イオン性化合物の中に存在することがあります。
イオン性化合物を形成するためのマイナスイオンとして作用する。
水酸化物イオンは系の塩基性を決定する化学種です。
系の塩基性は、その系に存在する水酸化物イオンの量を測定することによって決定することができる。
塩基性化合物では、その化合物の塩基性は、除去可能な水酸化物基の存在によって示される。
例えば、水酸化ナトリウム(NaOH)は高塩基性化合物であり、Na+カチオンとOH-アニオンから構成されている。
多くの金属は、水酸化物イオンと錯体を形成することができる。
これらは金属水酸化物と呼ばれます。
水酸化物イオンは求核剤として作用することができます。
ここで、これらの水酸化物イオンは、部分的に正電荷を持つ炭素原子を攻撃することができます。
時には、水酸化物イオンは反応の触媒として働くこともあります。
これを塩基触媒という。
水酸化物と水酸化物の違い
定義
Hydroxyl:水酸基は、分子に結合している原子団です。
ヒドロキシド 水酸化物は無機アニオンです。
自然
水酸基:水酸基は常に分子に結合した原子のグループとして存在する。
水酸化物 水酸化物は、アニオンとして自由な形で存在することができる。
化学結合
水酸基: 水酸基は共有結合を形成することができる。
水酸化物 水酸化物基はイオン結合を形成することができる。
電荷
水酸基:水酸基は一定の電荷を持たない。
水酸化物。
水酸化物は電荷が-1である陰イオンです。
反応性
水酸基:水酸基は分子の官能基として作用する。
水酸化物 水酸化物イオンは、陽イオンと反応してイオン性化合物を形成する。
結論
水酸基と水酸化物という用語は同じ意味で使われていますが、これらの用語にはいくつかの違いがあります。
水酸基と水酸化物の主な違いは、水酸基は自由な形では存在しないのに対し、水酸化物は自由な形で陰イオンとして見出されることです。
