分子式とは、化合物中に存在する原子とその量を表す方法です。
化合物の分子式は、元素記号とその比率で表される。
したがって、化合物の分子式の求め方を知ることは、化合物中に存在する元素とその量を知るために非常に重要です。
キーターム 原子量、炭素、経験式、水素、モル質量、分子式、酸素
分子式とは
分子式とは、化合物の化学式で、その化合物が構成する原子の種類と数についての情報を与えるものです。
しかし、原子の構造配置に関する情報は得られません。
また、原子と原子の間に存在する結合の種類と数についての情報も与えません。
分子式の求め方
化合物の分子式は、経験式を使って求めることができます。
経験式は、化合物中に存在する原子間の比率を示す化学式です。
各原子が何個存在するかはわかりません。
分子式を求める前に、化合物中に存在する各原子の質量パーセントから経験式を求める必要があります。
次の例で考えてみよう。
私たちの化合物は、36 %の炭素 (C)、58 %の酸素 (O)、残りは水素 (H) で構成されています。
この化合物のモル質量は60g/molと与えられている。
- まず、この化合物を100g持っていると仮定する。
- Hの存在割合は、=100 – (36+58) = 6%です。
- したがって、C の存在量は 36 g です。
H の存在量は 6 g
O の存在量は 58 g
- 次に、各原子のモル質量から質量を割って、モル数を求めます。
C = 36 g/ 12 gmol-1 = 3 mol
H = 6 g/ 1 gmol-1 = 6 mol
O = 58 g/ 16 gmol-1 = 3.625 mol
- 各原子のモル数を、その中で最も小さい数で割ってください。
C = 3/3
H = 6/3
O = 3.625/3
- 小数を取り除いて整数にする。
C = 1
H = 2
O = 1.208 (四捨五入して1)
- 上記の値を原子間の比率と考える。
- この比から経験式が求まる。
経験式はCH2Oです。
- モル質量は60g/molと出た。では、そこに存在するCH2Oの単位はどれくらいなのか、それを知る必要があります。そのためには、まず、経験式のモル質量を計算し、その計算値から与えられたモル質量の値を割る。
CH2Oのモル質量=(1×12)+(2×1)+(1×16)
= 12 + 2 + 16
= 30
したがって、この化合物中に存在するCH2Oのユニット数は
= 60/30
= 2
したがって、この化合物は (CH2O) x 2 となるはずです。
= C2H4O2
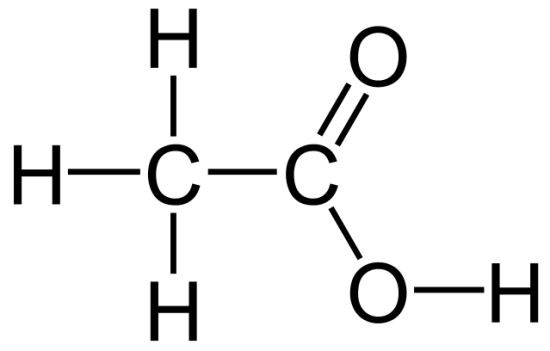 :図01 C2H4O2分子の提案
:図01 C2H4O2分子の提案
なぜ分子式を知ることが重要なのか?
分子式は、化合物中に存在する原子の種類とその比率を示す情報です。
分子式を知っていると、化合物を分類する際に便利です。
また、分子式は化合物のモル質量を表します。
モル質量を求める最も簡単な方法は、化合物中の各原子の原子質量を足し合わせることである。
したがって、分子式はモル質量を知るための鍵になる。
結論
今回は、化合物の分子式の求め方について説明しました。
分子式を求めるには、その化合物に含まれる各原子の質量%が分かっている必要があります。
