主な違い – ハイブリッド軌道 vs 分子軌道
軌道とは、電子を充填することができる仮想的な構造です。
様々な発見により、科学者はこれらの軌道に異なる形状を提案しています。
軌道には、原子軌道、分子軌道、ハイブリッド軌道の3種類があります。
原子軌道は、原子核の周囲にある仮想的な軌道です。
分子軌道は、2つの原子が共有結合したときにできる仮想的な軌道です。
ハイブリッド軌道は、原子軌道の混成によって形成される仮想的な軌道です。
ハイブリッド軌道と分子軌道の大きな違いは、ハイブリッド軌道が同じ原子の原子軌道の相互作用によって形成されるのに対し、分子軌道は異なる2つの原子の原子軌道の相互作用によって形成される点です。
ハイブリッドオービタルとは
ハイブリッド軌道とは、共有結合を作るために同一原子の原子軌道が混ざり合ってできた仮想的な軌道のことです。
つまり、原子の原子軌道は化学結合に適した軌道を作るために混成を行う。
原子の軌道には、S軌道、P軌道、D軌道、F軌道があります。
2つ以上の軌道がハイブリッド化すると、新しいハイブリッド軌道が形成される。
ハイブリッド軌道は、ハイブリッド化する原子軌道によって命名される。
以下にいくつかの例を示す。
sp ハイブリッドオービタル
s軌道とp軌道が1つずつ混在しているときにできる軌道です。
得られるハイブリッド軌道は、sの性質が50%、pの性質が50%です。
sp軌道の空間配置は直線的です。
したがって、これらの軌道間の結合角は180度です。
sp混成を起こした原子は2つの空のp軌道を持つ。
sp2 ハイブリッドオービタル
1つのs軌道と2つのp軌道が混成してできる軌道。
得られるハイブリッド軌道は、sが約33%、pが約66%です。
これらの軌道の空間配置は三角形の平面です。
したがって、これらの軌道間の結合角は120oCです。
この混成軌道をとる原子は、1つの空のp軌道を持つ。
sp3軌道
これらの軌道は、1つのs軌道と3つのp軌道が混成して形成される。
得られるハイブリッド軌道は、sが約25%、pが約75%です。
これらの軌道の空間配置は四面体です。
したがって、これらの軌道間の結合角は109.5oCです。
この混成軌道を持つ原子は空のp軌道を持たない。
sp3d1 オービタル
1つのs軌道、3つのp軌道、1つのd軌道が混成してできる軌道。
これらの軌道の空間的配置は三角形の平面状です。
この混成軌道をとる原子は、4つの空のd軌道を持つ。
上の図は、酸素分子が2つの水素原子と2つの共有結合を形成するために、原子軌道が混成している様子を示している。
分子軌道とは?
分子軌道とは、異なる原子の原子軌道が混ざり合って(重なり合って)できた仮想的な軌道のことです。
これは、2つの原子の間に共有結合が形成されたときに発生する。
例えば、A原子とB原子の間に共有結合が形成された場合、正しい対称性を持つ原子軌道が混ざり合い、分子軌道が形成される。
したがって、分子軌道は2つの原子の間で結合電子が最も多く存在できる領域です。
分子軌道には、結合軌道と反結合軌道の2種類があります。
結合分子軌道
分子軌道が形成される原子軌道と比較すると、これらの軌道のエネルギーは小さい。
したがって、これらの軌道は安定です。
結合電子対は、この軌道に存在することができる。
反結合分子軌道
原子軌道や結合分子軌道よりも高いエネルギーを持つ軌道。
そのため、安定性は低い。
ほとんどの場合、これらの軌道は空です。
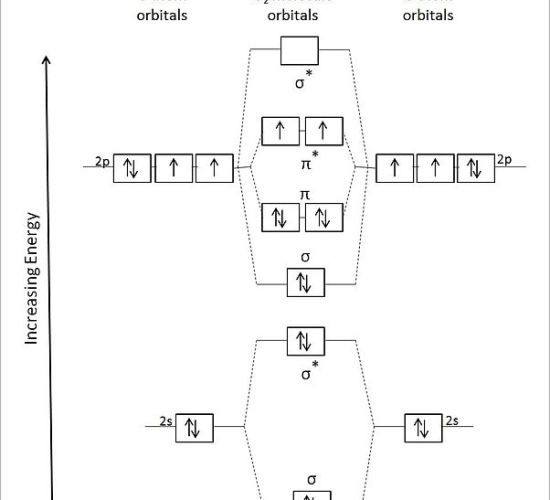 :図2 O2分子の分子軌道図
:図2 O2分子の分子軌道図
上の図は、二原子酸素の分子軌道図です。
σ “はシグマ結合の分子軌道を、”σ☆”は反結合の分子軌道を示す。
ハイブリッド軌道と分子軌道の類似性
- ハイブリッド軌道と分子軌道は、原子軌道の混在により形成される。
- どちらの軌道も結合電子対の最確位置を示している。
ハイブリッド軌道と分子軌道の違い
定義
ハイブリッド軌道。
ハイブリッド軌道とは、共有結合を作るために同一原子内の原子軌道が混ざり合ってできた仮想的な軌道。
分子軌道。
分子軌道とは、異なる原子の原子軌道が混ざり合い(重なり合い)形成される仮想的な軌道のこと。
原子
ハイブリッド軌道。
ハイブリッド軌道:同じ原子の中でハイブリッドな軌道を形成する。
分子軌道。
2つの原子の間に形成される分子軌道。
反結合軌道
ハイブリッド軌道 ハイブリッド軌道は、反結合軌道の情報を与えない。
分子軌道。
分子軌道は、反結合軌道の情報を与える。
結論
ハイブリッド軌道と分子軌道は、いずれも原子内または原子間の電子の最も可能性の高い位置を示す仮想的な軌道である。
分子の形状を予測する上で非常に重要です。
ハイブリッド軌道と分子軌道の主な違いは、ハイブリッド軌道は同じ原子の原子軌道の相互作用によって形成されるのに対し、分子軌道は異なる2つの原子の原子軌道の相互作用によって形成されることである。
