pHは、水質を決定するために測定される主要なパラメータです。
これは、水源が飲料目的やその他の家庭のニーズに合わせて使用するのに適した品質であるかどうかを示しています。
さらに、適切なpHを維持することは、いくつかの化学反応にとっても重要です。
システムのpHは、そのシステム内に存在する水素イオンの濃度に依存します。
溶液中の水素イオン濃度は、溶液1リットル中に存在する水素イオンの量(単位:mol)であり、pHは水素イオン濃度の逆数の対数値です。
これが、水素イオンとpHの関係です。
水素イオンとは
水素イオンは、水素元素のイオン形態で、H+という記号で表されます。
イオンは、原子に電子が付加されたり除去されたりしたときに形成されます。
原子から電子を取り除くと陽イオンになります。
原子に電子が加わると陰イオンになります。
水素は、気体状態では中性原子に1個の電子しか持っていません。
最も安定な水素の同位体は、原子核に陽子を含んでいます。
そのため、原子核の(陽子の存在による)正の電荷は、それが持つ唯一の電子によって中和されます。
しかし、この電子を水素原子から取り除くと、正電荷を帯びた陽子だけが存在することになります。
したがって、水素は水素イオンとなる。
このように、水素イオンはプロトンだけです。
水溶液中では、この水素イオンやプロトンはH2O(水)分子と結合しています。
そして、ヒドロニウムイオンと呼ばれます。
ヒドロニウムイオンの記号はH3O+です。
この記号は、H+-H2Oの組み合わせから作られます。
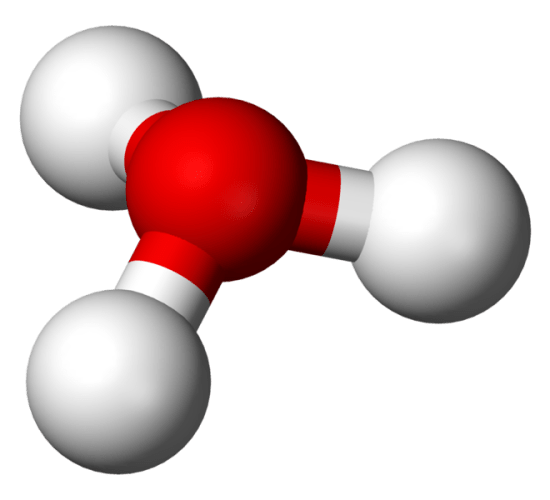 :図1 ヒドロニウムイオンの化学構造
:図1 ヒドロニウムイオンの化学構造
化合物の酸性度は、水素イオン(またはプロトン)を放出する能力によって決まります。
したがって、強酸とは、完全に電離して持っている水素イオンをすべて放出できる化合物です。
弱酸は、部分的にそのイオンに解離し、水素イオンの一部を放出できる化合物です。
ある系に存在する水素イオンの量は、その系のpHを見ることで判断することができます。
酸塩基滴定は、主に系に存在する水素イオンに基づいて行われます。
塩基は、酸の水溶液中に存在する水素イオンの数を決定するために使用することができます。
さらに、水素イオンは陰イオンとしても存在することができます。
水素原子は1s軌道に不対電子を持っているので、s軌道にもう一つ電子をもらって軌道を完成させ、ヘリウム(He)の電子配置を得ることができる。
そして、H-と表示される。
これは、水素原子が陽子で構成されており、入ってきた電子を中和する他の正電荷が原子に存在しないために起こる現象です。
一般に、水素は他の多くの元素に比べて電気陰性度が低いため、正のイオンを形成する傾向があります。
しかし、水素よりも電気陰性度が非常に低い金属などの元素と結合すると、陽イオンではなく陰イオンを形成する傾向があります。
pHとは
pHは、水素イオン濃度(正確には水素イオンの活量)の逆数の対数値です。
pHは、実際には系の酸性度や塩基度(アルカリ度)を決定するために用いられる尺度です。
対数的な値は、溶液中の水素イオン濃度が非常に少ないからです。
例えば、25℃の純水の水素イオン濃度は10-7 mol/L程度です。
そこで、活性の代わりに水素イオンの濃度を考え、その識別や比較を容易にするために対数値を用いているのです。
pHを計算する場合、水素イオン濃度の単位はmol/Lでとらえる必要がある。
pHは1~14まであり、pH7が系の中性pHとされている。
強酸は1~3のpH値を示し、弱酸は4~6のpH値を示します。
pHが14付近の系は強塩基性であるとされる。
図2:pHスケール
pHはさまざまな方法で測定することができる。
リトマス試験紙は、溶液が酸性か塩基性かを判断するのに用いることができ、pH試験紙は、pH値を整数で表すのに用いることができます。
また、滴定法も利用できます。
水素イオンとpHの関係
水素イオンとpHの間には直接的な関係があります。
溶液のpHは、その溶液中の水素イオン濃度に依存します。
pH値は、水素イオン活性の逆数の対数値です。
水素イオンの濃度は非常に低いことが多いので、イオン活性は水素イオンの濃度と等しいと考えられます。
そうすると、pHは水素イオン濃度の逆数の対数値となります。
pH = -log10[aH+] となります。
ここで、aは活性です。
pH = -log10[H+(aq)] となります。
したがって、pHと溶液中の水素イオン濃度には直接的な関係があります。
結論
溶液の pH は、主にその溶液中の水素イオン濃度に依存します。
水素イオン濃度は、溶液中に存在する化学種や溶液の温度変化により変化します。
