主な違い – ダニールセルとガルバニックセルの違い
電気化学セルとは、化学反応から電気を発生させたり、電気で化学反応を促進させたりすることができる装置です。
これらのセルは、2つのハーフセルで構成されています。
それぞれのハーフセルごとに電極と電解液があります。
両方の電極が同じ容器に入れられることもありますが、2つの電解質は多孔質のバリアを介して分離されています。
電気化学セルの例として、ダニールセルとガルバニックセルがあります。
ダニールセルは、電気化学セルの一種で、銅と亜鉛の電極で構成されています。
ガルバニックセルは、自発的な酸化還元反応によって生じる電気エネルギーを利用する電気化学セルです。
ダニールセルとガルバニックセルの主な違いは、ダニールセルが銅と亜鉛のみを電極として使用するのに対し、ガルバニックセルは様々な金属を電極として使用することができる点です。
ダニエルの細胞とは
ダニエール電池は電気化学電池の一種で、銅電極を硫酸銅(II)、亜鉛電極を硫酸亜鉛に浸したものである。
したがって、このセルには2つの電解質が使用されている。
電解質とは、水に溶かすとイオンに分離できる物質のことである。
このイオンは、その物質の水溶液中で電気を通すことができる。
ダニールセルの半セルは、硫酸銅(II)溶液に浸した銅電極と、硫酸亜鉛溶液に浸した亜鉛電極で構成される。
電気伝導のための電子を供給する酸化還元反応があります。
亜鉛は陽極として使用されます。
銅は陰極です。
2つの半反応を以下に示す。
陽極 : Zn(s) → Zn+2(aq) + 2e
陰極 : Cu+2(aq) + 2e → Cu(s)
陽極では、亜鉛が酸化されて亜鉛(II)イオンになります。
陰極では、銅(II)イオンが還元されて銅になります。
全反応は以下のように与えられる。
Zn(s) + Cu+2(aq) → Zn+2(aq) + Cu(s)
このセルを簡単に説明するために、2つの電解質は互いに分離され、イオンの移動には塩橋が使用される。
塩橋の中には、セル内で起こる酸化還元反応を妨げない化合物を入れておく。
しかし、実際のダニエルのセルでは、2つの電解液を隔てるために多孔質のバリアが使われている。
この多孔質バリアでは、銅イオンが硫酸亜鉛に移動したり、逆に硫酸亜鉛が銅イオンに移動したりするのを制御できない。
そのため、充電ができないのです。
ガルバニックセルとは
ガルバニック電池とは、電気化学電池の一種で、自発的な酸化還元反応を利用して電気エネルギーを発生させるものです。
ボルタイックセルとも呼ばれる。
セルは2つのハーフセルで構成されています。
それぞれのハーフセルは、電極と電解質で構成されています。
電極は電解液に浸かっている。
これらの電解質は完全に分離している場合もあれば、多孔質のバリアーによってのみ分離している場合もあります。
電解液が完全に分離している場合は、塩橋を使用して2つの電解液間のイオンの動きを維持する。
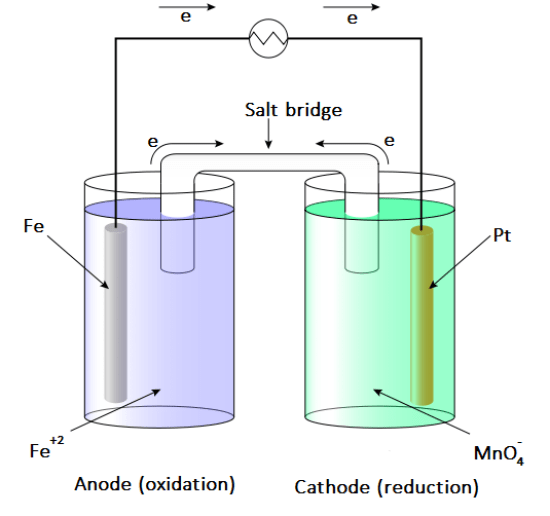 :図2 ガルバニ電池の例
:図2 ガルバニ電池の例
電極と電解質は、自然発生的か否かを考慮して選択する。
これは、各半セルの電極電位を計算することで理論的に求めることができます。
ただし、一方の半セルは酸化反応を示し、他方の半セルは還元反応を示すはずです。
酸化は陽極で起こり、還元は陰極で起こります。
ガルバニック(ボルタ)電池は、自発的な酸化還元反応の際に放出されるエネルギーを利用して電気を発生させるので、電気エネルギー源として使用されます。
直流電流を発生させることができる。
ダニールセルとガルバニックセルの類似点
- どちらも電解槽の一例です。
- どちらも電極と電解質で構成された半セルで構成されている。
- 電解質は完全に分離しているか、多孔質膜で分離されているかのどちらかです。
ダニールセルとガルバニックセルの違い
定義
ダニールセル:ダニールセルは電気化学セルの一種で、銅電極を硫酸銅(II)、亜鉛電極を硫酸亜鉛に浸して構成される。
ガルバニ電池:電気化学電池の一種で、自発的な酸化還元反応を利用して電気エネルギーを発生させる電池。
陽極
ダニールセル:ダニールセルのアノードは、亜鉛電極です。
ガルバニ電池:ガルバニ電池の陽極は、酸化できる金属です。
カソード
ダニールセル:ダニールセルのカソードは銅の電極です。
ガルバニ電池のカソードは、還元可能な金属である。
電解質
ダニールセル:硫酸銅(II)と硫酸亜鉛を電解質として使用します。
ガルバニ電池: 電解質は、各電極の金属塩を使用する。
結論
ダニエール電池とガルバニ電池は、いずれも電気化学的な電池です。
これらの電池は、自発的な酸化還元反応を利用して電気エネルギーを発生させる。
この生成されたエネルギーは、外部で行われる仕事に使用することができます。
ダニエルとガルバニ電池の主な違いは、ダニエルは銅と亜鉛のみを電極として使用するのに対し、ガルバニ電池は様々な金属を電極として使用することができる点です。
